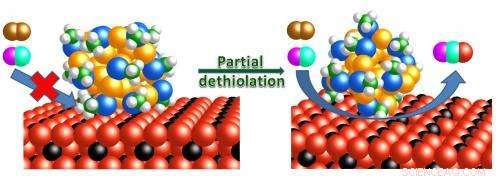
O mecanismo de reação da oxidação do monóxido de carbono é mostrado em nanoclusters de ouro intactos e parcialmente removidos do ligante, suportados em hastes de óxido de cério. Crédito:Wu, Z., et al.
(Phys.org) —O pensamento antigo era aquele ouro, embora seja bom para joias, não era muito útil para químicos porque é relativamente não reativo. Isso mudou há uma década, quando os cientistas encontraram uma rica veia de descobertas revelando que este metal nobre, quando estruturado em partículas de tamanho nanométrico, pode acelerar reações químicas importantes na mitigação de poluentes ambientais e na produção de especialidades químicas difíceis de fabricar. Desde então, nanopartículas catalíticas de ouro estimularam centenas de artigos em revistas científicas. Com o mercado mundial de catalisadores prestes a atingir US $ 19,5 bilhões em 2016, nanopartículas de ouro podem ter importância comercial, bem como intelectual, pois podem levar a novos catalisadores de energia, farmacologia e diversos produtos de consumo.
Mas antes que as nanopartículas de ouro possam ser úteis para os consumidores, os pesquisadores precisam torná-los estáveis e ativos. Recentemente, cientistas aprenderam a fazer minúsculos, aglomerados altamente ordenados com números muito específicos de átomos de ouro que são estabilizados por compostos chamados ligantes. Esses aglomerados de ouro estabilizados mais ligantes podem ser considerados moléculas grandes. Em colaboração com cientistas da Carnegie Mellon University, pesquisadores do Laboratório Nacional Oak Ridge do Departamento de Energia descobriram uma nova molécula de ouro, um catalisador contendo exatamente 25 átomos de ouro, isso é poderoso e sofisticado. Catalisa a conversão de uma variedade de moléculas, incluindo a transformação de monóxido de carbono venenoso em dióxido de carbono inofensivo, uma reação que pode ser aplicada em dispositivos próximos a dutos de gás ou fogões a lenha. Infelizmente, os ligantes que criam e estabilizam os aglomerados projetados também bloqueiam os próprios locais necessários para catalisar a conversão de monóxido de carbono em dióxido de carbono.
"Os ligantes são espadas de dois gumes, "disse o líder do estudo Zili Wu, do ORNL, cuja investigação foi conduzida no grupo de catálise de ORNL, que é liderado por Steve Overbury. "Estamos interessados em usar aglomerados de ouro como catalisadores ou precursores de catalisadores. Os ligantes, por um lado, estabilizam a estrutura da partícula de ouro, mas, por outro lado, diminuem seu desempenho catalítico. Equilibrar esses dois fatores é a chave para criar um novo sistema catalítico. Um maneira é utilizar um óxido de metal (aqui, óxido de cério) como um ligante inorgânico para estabilizar os aglomerados de ouro quando o ligante orgânico deve ser removido para a catálise. "
Muitos sistemas catalíticos consistem em partículas de metal com propriedades catalíticas colocadas em um suporte de óxido de metal com propriedades catalíticas próprias. O metal e o óxido de metal trabalham juntos para criar um novo tipo de atividade catalítica. "Estamos tentando entender como isso acontece, "Wu disse.
Seu estudo, publicado no Jornal da American Chemical Society , descreveu como os ligantes permitiram que o nanocluster de ouro se encaixasse em um suporte de óxido de cério em forma de haste. Os catalisadores produzidos eram todos idênticos. Os pesquisadores gostariam de projetar futuros suportes de óxido na forma de cubos ou octaedros para descobrir como essas nanoestruturas poderiam alterar a configuração do ouro e a reatividade do sistema de componente final. Uma melhor compreensão dos agentes estabilizadores pode auxiliar no projeto de novos catalisadores para reações químicas críticas, incluindo oxidação, hidrogenação e acoplamento.
Carnegie Mellon Professor Rongchao Jin, seu aluno Chenjie Zeng e os bolsistas de pós-doutorado do ORNL Amanda Mann e Zhen-An Qiao sintetizaram os aglomerados de ouro. Mann fez as hastes de óxido de cério. Wu e Mann colocaram os aglomerados de ouro nos suportes e realizaram estudos de reação química. David Mullins, do ORNL, realizou medições da estrutura fina de absorção de raios-X estendida para aprender como os tamanhos dos aglomerados mudam com a temperatura. Larry Allard do ORNL verificou a natureza das estruturas com microscopia com correção de aberração, e De-en Jiang, anteriormente do ORNL, mas agora na University of California – Riverside, usou o Oak Ridge Institutional Cluster para explorar computacionalmente estruturas de aglomerados de ouro ligados a ligantes.
Ativando ouro
"Esses ligantes afetam a reatividade - eles essencialmente envenenam a superfície do ouro - então o ouro realmente precisa ser ativado, "Overbury, o autor sênior do estudo, explicado. "Colocamos o ouro em um suporte, e tem esses ligantes protegendo-o. Temos que remover esses ligantes, então basicamente aquecemos esse [nanoaglomerado de ouro] ou o tratamos com um pouco de gás a temperaturas elevadas. "
Quando os cachos de ouro são aquecidos, os ligantes começam a se desprender e a atividade catalítica do ouro aumenta. The optimal temperature for producing gold nanocluster catalysts for carbon monoxide oxidation is 498 Kelvin (225 degrees Celsius or 437 degrees Fahrenheit), Disse Wu. If heating increases further, catalytic activity decreases because the gold particles become fluid and aggregate on the support.
Next the scientists are interested in varying the gold-cluster size and stabilizing the new clusters to make novel uniform catalysts. "We want to understand how other kinds of reactions can be catalyzed by these. So far we've only looked at carbon monoxide oxidation, which is kind of a test reaction, " Overbury said. "Our primary interest is using the gold-nanocluster complex as a toolbox for learning about how other complex reactions occur."
Added Overbury, "We're only just starting to mine all the catalytic possibilities for gold."
DOE's Office of Science sponsored the research described in the Jornal da American Chemical Society papel. Raman and Fourier transform infrared spectroscopies and catalytic measurements were conducted at the Center for Nanophase Materials Sciences, a DOE Office of Science User Facility at ORNL. Extended X-ray absorption fine structure work was performed at the National Synchrotron Light Source, which is also a DOE Office of Science User Facility, at Brookhaven National Laboratory.