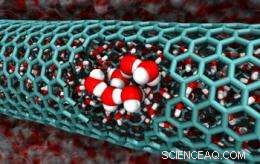
 p Esta imagem das simulações da equipe Caltech apresenta um corte de um nanotubo de carbono de 2,0 nanômetros de diâmetro, revelando moléculas de água confinadas. [Crédito:Caltech / Tod Pascal]
p Esta imagem das simulações da equipe Caltech apresenta um corte de um nanotubo de carbono de 2,0 nanômetros de diâmetro, revelando moléculas de água confinadas. [Crédito:Caltech / Tod Pascal]
p Os cientistas costumam encontrar coisas estranhas e inesperadas quando olham para materiais em nanoescala - o nível de átomos e moléculas individuais. Isso vale até mesmo para os materiais mais comuns, como água. p Caso em questão:nos últimos dois anos, pesquisadores observaram que a água flui espontaneamente em tubos extremamente pequenos de grafite ou grafeno, chamados nanotubos de carbono. Esta observação inesperada é intrigante porque os nanotubos de carbono são promissores nos campos emergentes da nanofluídica e da nanofiltração, onde os nanotubos podem ajudar a manter fluxos minúsculos ou separar as impurezas da água. Contudo, ninguém conseguiu explicar o porquê, no nível molecular, um líquido estável gostaria de se confinar a uma área tão pequena.
p Agora, usando um novo método para calcular a dinâmica das moléculas de água, Os pesquisadores da Caltech acreditam que resolveram o mistério. Acontece que a entropia, uma medida de desordem, foi a chave que faltava.
p "É um resultado bastante surpreendente, "diz William Goddard, o professor de química Charles e Mary Ferkel, Ciência de materiais, e Física Aplicada no Caltech e diretor do Centro de Simulação de Materiais e Processos. "As pessoas normalmente se concentram na energia neste problema, não entropia. "
p Isso porque a água forma uma extensa rede de ligações de hidrogênio, o que o torna muito estável. Romper essas interações fortes requer energia. E uma vez que algumas ligações precisam ser quebradas para que a água flua em pequenos nanotubos, parece improvável que a água o faça livremente.
p "O que descobrimos é que, na verdade, é uma troca, "Goddard diz." Você perde um pouco da boa estabilização de energia da ligação, mas no processo você ganha em entropia. "
p A entropia é uma das forças motrizes que determinam se um processo ocorrerá espontaneamente. Ele representa o número de maneiras pelas quais um sistema pode existir em um determinado estado. Quanto mais arranjos disponíveis para um sistema, quanto maior sua desordem, e quanto maior a entropia. E em geral, a natureza avança em direção à desordem.
p Quando a água está idealmente ligada, todas as ligações de hidrogênio prendem as moléculas no lugar, restringindo sua liberdade e mantendo a entropia da água baixa. O que Goddard e o pós-doutorado Tod Pascal descobriram é que, no caso de alguns nanotubos, a água ganha entropia suficiente ao entrar nos tubos para compensar as perdas de energia incorridas pela quebra de algumas de suas ligações de hidrogênio. Portanto, a água flui espontaneamente para os tubos.
p Goddard e Pascal explicam suas descobertas em um artigo publicado recentemente no
Proceedings of the National Academy of Sciences (PNAS) . Eles analisaram nanotubos de carbono com diâmetros entre 0,8 e 2,7 nanômetros e encontraram três razões diferentes pelas quais a água fluiria livremente para os tubos, dependendo do diâmetro.
p Para os menores nanotubos - aqueles entre 0,8 e 1,0 nanômetro de diâmetro - os tubos são tão minúsculos que as moléculas de água se alinham em quase um único arquivo dentro deles e assumem um estado semelhante ao de um gás. Isso significa que a estrutura normal ligada da água líquida se quebra, dando às moléculas maior liberdade de movimento. Esse aumento na entropia puxa a água para os tubos.
p No próximo nível, onde os nanotubos têm diâmetros entre 1,1 e 1,2 nanômetros, moléculas de água confinadas se organizam em pilhas, cristais semelhantes a gelo. Goddard e Pascal descobriram que esses nanotubos têm o tamanho perfeito - uma espécie de correspondência Cachinhos Dourados - para acomodar água cristalizada. Essas interações de ligação de cristais, não entropia, torná-lo favorável para que a água flua para os tubos.
p Na maior escala estudada - envolvendo tubos cujos diâmetros ainda têm apenas 1,4 a 2,7 nanômetros de largura - os pesquisadores descobriram que as moléculas de água confinada se comportam mais como água líquida. Contudo, Mais uma vez, algumas das ligações normais de hidrogênio são quebradas, portanto, as moléculas exibem mais liberdade de movimento dentro dos tubos. E os ganhos na entropia mais do que compensam a perda na energia das ligações de hidrogênio.
p Como o interior dos nanotubos de carbono são muito pequenos para os pesquisadores examinarem experimentalmente, Goddard e Pascal estudaram a dinâmica das moléculas de água confinada em simulações. Usando um novo método desenvolvido pelo grupo de Goddard com um supercomputador, eles foram capazes de calcular a entropia para as moléculas de água individuais. No passado, tais cálculos têm sido difíceis e extremamente demorados. Mas a nova abordagem, apelidado de modelo termodinâmico de duas fases, tornou a determinação dos valores de entropia relativamente fácil para qualquer sistema.
p "Os métodos antigos levavam oito anos de processamento de computador para chegar às mesmas entropias que estamos obtendo agora em 36 horas, "Goddard diz.
p A equipe também fez simulações usando uma descrição alternativa de água - uma em que a água tinha suas propriedades usuais de energia, densidade, e viscosidade, mas faltou sua ligação de hidrogênio característica. Nesse caso, a água não queria fluir para os nanotubos, fornecendo uma prova adicional de que a baixa entropia natural da água devido à extensa ligação de hidrogênio leva a que ela preencha nanotubos de carbono espontaneamente quando a entropia aumenta.
p Goddard acredita que os nanotubos de carbono podem ser usados para projetar supermoléculas para a purificação da água. Ao incorporar poros com os mesmos diâmetros dos nanotubos de carbono, ele acha que um polímero poderia ser feito para sugar a água da solução. Essa aplicação potencial aponta para a necessidade de uma maior compreensão do transporte de água através de nanotubos de carbono.
