O ponto crítico:por que os físicos ainda estão lutando para entender a capacidade do gelo de aderir e se tornar escorregadio
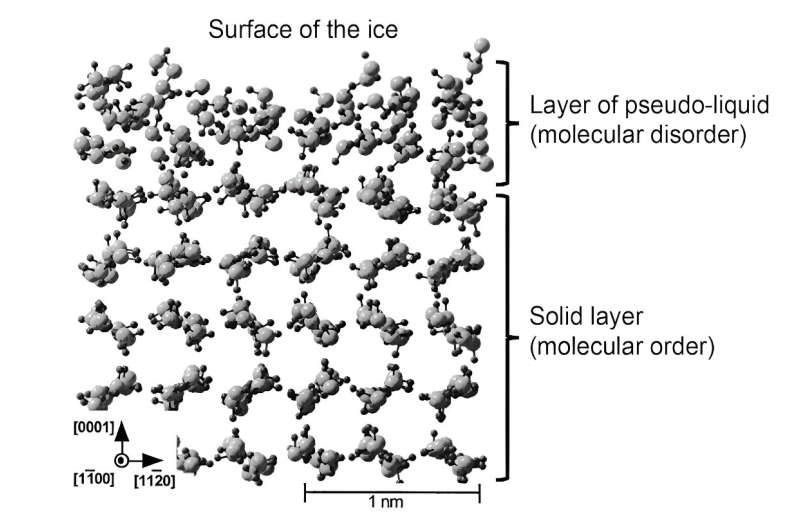 Modelagem da estrutura do gelo onde podemos ver a desordem estrutural específica dos líquidos com espessura de uma a duas moléculas. Mais profundamente no gelo, encontramos a estrutura ordenada (cristalina) do gelo. Crédito:Philippe Brunet, adaptado de T. Ikeda-Fukazawa e K. Kawamura, Fourni par l'auteur
Modelagem da estrutura do gelo onde podemos ver a desordem estrutural específica dos líquidos com espessura de uma a duas moléculas. Mais profundamente no gelo, encontramos a estrutura ordenada (cristalina) do gelo. Crédito:Philippe Brunet, adaptado de T. Ikeda-Fukazawa e K. Kawamura, Fourni par l'auteur Seja na forma de gelo ou de um cubo de gelo liso e transparente, o gelo adere espontaneamente e até com bastante força a muitas superfícies sólidas. No entanto, como qualquer pessoa descuidada que tenha derrapado numa calçada de inverno pode testemunhar, o gelo também pode ser muito escorregadio. Na verdade, o gelo pode ser pegajoso
e escorregadio.
Essa versatilidade há muito intriga os cientistas. Para começar, eles vêm tentando desvendar o segredo por trás do escorregadio do gelo há mais de 150 anos. Entre eles estavam físicos famosos como Lord Kelvin e Michael Faraday. Este último, mais conhecido pelo seu trabalho em eletromagnetismo, foi o primeiro a prever a presença de uma fina camada de água líquida cobrindo o gelo, mesmo bem abaixo de 0°C. Na época, ele concluiu que o contato de um objeto sólido contra a camada superficial fazia com que ele atuasse como lubrificante, reduzindo bastante o atrito no gelo. A existência desta camada líquida foi confirmada por experiências mais de um século depois.
Um assunto escorregadio
Para responder à pergunta “Por que o gelo é escorregadio?” primeiro precisamos entender como surgiu essa fina camada de água líquida na superfície congelada.
Como a água é mais densa na fase líquida do que no estado gelado, durante muito tempo pensou-se que o derretimento da superfície do gelo estava ligado ao excesso de pressão - por exemplo, devido ao peso do patinador na pequena área de superfície situada abaixo dela ou seus patins. Ao comprimir ainda mais o gelo, o patinador faria com que ele derretesse, tornando-o líquido e escorregadio.
Outros acreditam que o calor é liberado por fricção à medida que o objeto se move sobre o gelo, causando o derretimento da superfície. Assim como quando você esfrega as mãos para aquecê-las, quando você esfrega um sólido contra o outro, elas esquentam.
No entanto, estes dois mecanismos não explicam porque é que o gelo permanece escorregadio abaixo dos -20°C. A tais temperaturas, seria necessária uma pressão considerável – cerca de 500 vezes a exercida por um patim de gelo – para derreter.
Na década de 1960, mais de um século depois de Faraday, J.W. Telford e J.S. Turner puxou lentamente um fio através do gelo "frio" (abaixo de -20°C) para revelar que ele permanecia escorregadio até -35°C, ponto em que o calor liberado pela fricção não era mais suficiente para derreter o gelo.
Foi apenas cerca de um século depois da intuição de Faraday que fomos capazes de demonstrar indirectamente esta camada líquida, medindo as propriedades da superfície do gelo e não o volume - neste caso as suas propriedades de absorção de vapores de hidrocarbonetos, que são bastante comparáveis às do gelo. água líquida!
Técnicas que envolvem espalhamento de prótons ou raios X, normalmente utilizadas para estudar a estrutura dos cristais, permitiram estimar a espessura entre uma e várias centenas de nanômetros. Alguns estudos sugeriram mesmo que esta espessura diverge à medida que a temperatura se aproxima de 0°C.
Mais recentemente, simulações permitiram representar melhor a estrutura desta camada líquida. Posteriormente, esta camada foi referida como "pseudo-líquida" ou "quase-líquida" para diferenciá-la da verdadeira fase líquida. Tal trabalho teórico mostrou que nesta camada superficial as moléculas conseguem se movimentar com mais liberdade, confirmando seu papel como lubrificante. No entanto, a estrutura molecular não é exatamente a mesma da água líquida, o que tem consequências nas propriedades mecânicas desta camada pseudolíquida.
Um estudo recente mostrou uma forte correlação entre a mobilidade individual das moléculas e o coeficiente macroscópico de atrito (quanto menor o coeficiente, mais fácil é planar), sugerindo que não é tanto a espessura da camada que importa para o deslizamento. mas sim o movimento individual das moléculas. O valor mínimo do coeficiente de atrito é medido a -7°C, conhecida como a temperatura ideal para esquiadores e patinadores.
Outras pesquisas foram ao cerne da camada pseudolíquida usando uma nano-sonda, a ponta de um microscópio de força atômica. Ao vibrar essa ponta conectada a um sensor de força extremamente preciso, medindo o atrito entre a ponta e o líquido da camada, os autores mediram que esse líquido pode ser 50 vezes mais viscoso que a água líquida, e que também possui elasticidade (uma propriedade mais associado ao estado sólido). Essa viscosidade é semelhante à dos óleos comestíveis, tornando a camada pseudolíquida um excelente lubrificante.
Resumindo:o gelo desliza porque uma camada líquida de cerca de 1 a 100 nanômetros de espessura se forma em sua superfície. As suas propriedades mecânicas (viscosidade, elasticidade), diferentes das da água líquida, e a mobilidade das moléculas que a compõem, muito superior à do gelo sólido, conferem-lhe propriedades lubrificantes excepcionais.
Por que o gelo gruda?
A viscosidade do gelo, no entanto, continua a confundir os cientistas, apesar de 70 anos de experiências. Durante este último, os cientistas tenderam a utilizar um kit bastante simples:um pistão conectado ao sensor de força empurra um bloco de gelo, ele próprio preso a um objeto sólido. Quando o cubo de gelo se rompe, a força registrada pelo sensor torna-se repentinamente zero e o valor máximo antes dessa ruptura é medido. Mas estes resultados revelaram tendências por vezes contraditórias e uma dispersão bastante ampla.
Uma revisão recente sobre o assunto concluiu que a força de adesão do gelo "depende não apenas da composição química, rugosidade superficial, propriedades mecânicas e térmicas do substrato [mas] também depende criticamente da temperatura e até mesmo do dispositivo experimental para medir a adesão ."
Para ser um pouco mais preciso, quando exploramos a literatura sobre o assunto nos últimos 60 anos, notamos que a força com que o gelo adere a um sólido depende fortemente da temperatura num intervalo entre -20°C e 0°C ( o gelo adere com mais força a um sólido mais frio). Quanto ao papel da rugosidade superficial, é ambivalente:para alguns sólidos (particularmente metais), o gelo adere mais fortemente a um substrato mais áspero, enquanto em alguns plásticos acontece o contrário…
Finalmente, a nível químico, a água líquida pode espalhar-se melhor em algumas superfícies do que em outras. Por exemplo, a água se espalha muito bem em vidro limpo, enquanto algumas superfícies são hidrofóbicas, como o Teflon.
Um estudo recente mostrou que quanto mais água no estado líquido se espalha pela superfície de um sólido, mais gelo irá aderir a esse sólido. Por outro lado, uma superfície com pouca afinidade pela água líquida também terá pouca adesão ao gelo.
Por que esta relação entre a propagação da água e a adesão do gelo? Primeiro, para que o gelo adira a um sólido frio, a água no seu estado líquido deve ter sido capaz de congelar em contacto com o sólido. Aqui está uma experiência simples que qualquer pessoa pode fazer:
- Coloque um prato de metal no freezer ou na bandeja de cubos de gelo.
- Pegue um cubo de gelo e coloque-o no prato sem tirar tudo do freezer:não gruda.
- Pegue outro cubo de gelo e deixe-o derreter ligeiramente à temperatura ambiente (tirando-o do congelador por alguns segundos, por exemplo), depois coloque-o no prato frio. Desta vez pega!
O que podemos concluir? Intuitivamente, quanto maior a afinidade da água pela superfície, mais facilmente a água líquida penetra nas rugosidades e lacunas da superfície do sólido, aumentando a superfície de contato entre ele e o gelo após a solidificação, consolidando assim a adesão. Este experimento também demonstra o papel da água líquida como adesivo. Quando você usa um adesivo convencional – digamos, cola líquida – para unir duas partes, é quando as partes solidificam (pela evaporação de um solvente na cola) que ocorre a adesão forte e definitiva. A mesma coisa acontece quando a água líquida esfria ao entrar em contato com um sólido frio e solidifica. A camada de água congelada desempenha então o papel de um dos sólidos.
Como o gelo pode se tornar menos adesivo?
Não podemos explicar detalhadamente a adesão do gelo, mas podemos tentar reduzir a sua resistência. A ideia de utilizar tratamentos hidrorrepelentes surgiu naturalmente, mas estes tratamentos não são muito robustos ao longo do tempo e podem ter o efeito oposto ao pretendido. Soluções mais promissoras envolvem espalhar uma fina camada de óleo ou hidrogel sobre a superfície, mas ainda existem problemas com a estabilidade dessas camadas em grandes áreas.
Outra abordagem é usar métodos ativos de descongelamento. Uma dessas técnicas é o ultrassom de superfície, que gera “microterremotos” na superfície sólida e pode causar a quebra do gelo. Atualmente estamos estudando esse método no laboratório do MSC.
