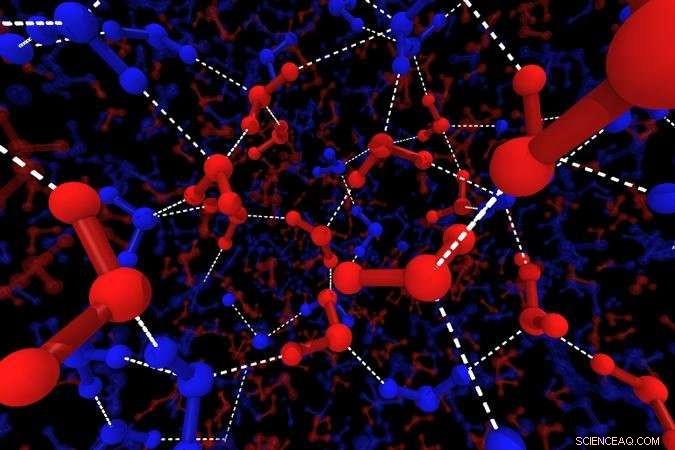
Ilustração das estruturas locais da água. As linhas azuis mostram as moléculas de H2O de estrutura tetraédrica, as linhas vermelhas mostram moléculas de H2O de estrutura desordenada. As grandes bolas mostram átomos de oxigênio, as pequenas bolas mostram hidrogênio e as linhas brancas pontilhadas representam ligações de hidrogênio. Crédito:2018 Hajime Tanaka, Instituto de Ciência Industrial, A Universidade de Tóquio
Uma equipe de pesquisa japonesa liderada pela Universidade de Tóquio investigou a transição da água de frágil para forte. Ao contrário da maioria dos líquidos, quando a água é resfriada, a taxa de aumento de sua viscosidade atinge um máximo a uma certa temperatura baixa. A equipe mostrou que modelar a água como uma mistura dependente da temperatura de dois estados - água rápida desordenada e água lenta ordenada localmente - explicou a transição frágil para forte e evitou as previsões erradas de teorias anteriores baseadas no comportamento vítreo.
A água é estranha em muitos aspectos. Algumas de suas peculiaridades químicas são familiares, como expandir quando congela em gelo. Uma curiosidade menos conhecida, que ele compartilha com apenas alguns outros líquidos, é a transição de frágil para forte. Explicando este comportamento, que se relaciona com a forma como a água fria flui, tem sido uma fonte de debate. Agora, uma explicação convincente foi apresentada por pesquisadores em Tóquio.
Quando os líquidos esfriam, sua dinâmica diminui e eles se tornam viscosos. Para a maioria dos líquidos, a taxa de desaceleração é constante em função da temperatura e são conhecidos como líquidos fortes. Para líquidos frágeis, Contudo, a taxa aumenta continuamente à medida que a temperatura cai. A água é incomum a esse respeito - é frágil em temperatura ambiente, mas forte em baixas temperaturas, onde sua taxa de aumento da viscosidade atinge um pico.
Esta transição de frágil para forte é indescritível, ocorrendo apenas no regime super-resfriado, abaixo do ponto de congelamento normal da água. Os primeiros modelos tentaram vinculá-lo à dinâmica vítrea, já que a água super-resfriada é conhecida como formadora de vidro. Contudo, uma equipe liderada pelo Instituto de Ciência Industrial da Universidade de Tóquio (IIS) propõe uma teoria de dois estados, na verdade, modelar a água como uma mistura de dois líquidos coexistentes.
Matematicamente, a distinção forte / frágil repousa na lei de Arrhenius para processos dinâmicos - líquidos fortes obedecem a esta lei, mas para os frágeis, o rápido aumento da viscosidade é super-Arrhenius. Conforme relatado no jornal PNAS , a equipe do IIS alterou essa visão considerando que a água consiste em dois estados, denominado "rápido" e "lento, "que são estruturalmente diferentes, mas ambos obedecem à dinâmica de Arrhenius.
"Simulamos água por dinâmica molecular e procuramos padrões estruturais, "explica o co-autor do estudo, Rui Shi." As moléculas de H2O sempre se agrupam em tetraedros, mas vimos que algumas dessas estruturas locais eram altamente organizadas, outros nem tanto. "Os estados desordenados correspondem à água rápida, e dominar em alta temperatura, enquanto o estado lento bem ordenado assume conforme a amostra esfria.
Crucialmente, as equações derivadas do modelo de dois estados predizem com sucesso o cruzamento frágil para forte. Isso acontece bem acima do ponto de transição vítrea - o comportamento vítreo parece ser uma pista falsa no que diz respeito a esse problema. O fato de que a água rápida tem Arrhenius, ao invés de lei de potência, A dinâmica também resolve previsões erradas com base em tentativas anteriores de vincular a fragilidade da água a certos aspectos de seu diagrama de fase.
"Água frágil pode ser uma ilusão. A transição aparente é um artefato do equilíbrio dependente da temperatura de dois estados líquidos fortes, "diz o autor Hajime Tanaka." A presença de dois estados reflete a tendência da água de formar estruturas locais, o que é mais fácil em baixa temperatura. Na verdade, outros líquidos com uma transição de frágil para forte, como sílica, também mostram pedidos locais. Propomos que este, ao invés de qualquer comportamento vítreo, é o que os distingue dos verdadeiros líquidos frágeis. "