Cientistas encontram novas maneiras de converter inibidores em degradadores, abrindo caminho para futuras descobertas de medicamentos
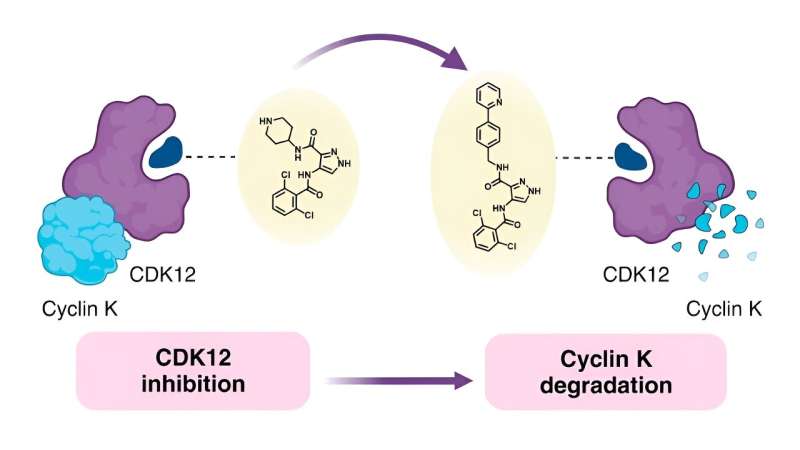 Gráfico representando a degradação de proteínas. Crédito:Crédito:ACS Chemical Biology (2024). DOI:10.1021/acschembio.3c00616
Gráfico representando a degradação de proteínas. Crédito:Crédito:ACS Chemical Biology (2024). DOI:10.1021/acschembio.3c00616 Os pesquisadores descobriram maneiras de converter medicamentos contra o câncer direcionados ao estilo inibidor em pequenas moléculas conhecidas como degradadores, que ajudam a destruir proteínas promotoras de câncer nas células.
Os cientistas selecionaram moléculas conhecidas por inibir certas proteínas – interrompendo a sua função – e modificaram-nas de várias maneiras para convertê-las em degradadores de proteínas, que decompõem a proteína.
Outros cientistas podem agora replicar esta nova abordagem para desenvolver e otimizar uma gama de degradadores de proteínas. A longo prazo, isto pode ajudar a tornar os tratamentos existentes contra o cancro mais eficazes e a criar novos tratamentos para atingir diferentes proteínas envolvidas no cancro, incluindo proteínas que anteriormente podem ter sido consideradas “indrogáveis”.
A pesquisa, liderada por pesquisadores do Instituto de Pesquisa do Câncer, em Londres, foi publicada na ACS Chemical Biology. .
A necessidade de otimizar a degradação proteica direcionada
Cientistas de todo o mundo têm investigado a degradação proteica direcionada como forma de eliminar proteínas específicas conhecidas por desempenharem um papel no desenvolvimento ou progressão do cancro. As células decompõem naturalmente proteínas danificadas ou desnecessárias, e é possível sequestrar este processo introduzindo as moléculas certas do medicamento para que as células destruam as proteínas cancerígenas.
O ICR está empenhado em pesquisar a degradação proteica direcionada como forma de descobrir novos tratamentos contra o câncer. Em 2022, uma grande doação filantrópica tornou possível a abertura de um novo Centro para Degradação de Proteínas dentro do Centro para Descoberta de Medicamentos contra o Câncer do ICR.
Os pesquisadores já obtiveram algum sucesso usando quimeras direcionadas à proteólise (PROTACs). Eles se ligam à proteína de interesse e a uma enzima chamada ubiquitina ligase E3 para aproximar os dois. A enzima então rotula a proteína com ubiquitina, que a marca para destruição pela célula.
No entanto, o peso molecular relativamente elevado dos PROTACs limita a sua utilização, uma vez que não se dissolvem bem em água e podem ter dificuldade em entrar nas células numa concentração suficientemente elevada para serem eficazes. Por outro lado, se a concentração se tornar demasiado elevada, todos os PROTACs ligam-se apenas a um dos dois compostos – a enzima ou a proteína alvo – em vez de ambos, o que significa que a degradação da proteína é incompleta.
Uma descoberta mais recente foi o uso de degradadores monovalentes, frequentemente chamados de colas moleculares. Eles funcionam de maneira semelhante aos PROTACs, mas modificam quimicamente a superfície da enzima ou da proteína alvo para que ambas possam se ligar diretamente. Estes compostos superam as limitações dos PROTACs porque são menores e ainda eficazes em concentrações mais elevadas.
Um medicamento de cola molecular, descoberto após um programa de pesquisa no ICR, já está em fase inicial de testes clínicos.
Transformando inibidores em degradadores
Querendo compreender a ligação entre a estrutura química das colas moleculares e como elas se comportam - conhecida como relação estrutura-atividade (SAR) - os pesquisadores por trás do presente estudo decidiram usar um degradador monovalente conhecido chamado CR8 como ponto de partida. CR8 inibe todas as quinases dependentes de ciclina (CDKs), que desempenham múltiplas funções no desenvolvimento de tumores, mas também degrada a proteína ciclina K, que promove vias de sinalização do câncer.
Pesquisas anteriores mostraram que o CR8 se liga ao CDK12 e a um componente da ligase E3 chamado proteína 1 de ligação ao DNA danificada (DDB1). Isso permite que a célula decomponha a ciclina K ligada ao CDK12.
Munida desta informação, a equipe tentou substituir a piridina no CR8 por uma ampla gama de substitutos. Eles primeiro tentaram usar grupos simples, incluindo flúor, metila e hidroxila, antes de passarem para formações mais complexas para determinar como essas mudanças afetavam a capacidade de degradação.
Na segunda parte do estudo, os investigadores aplicaram a sua maior compreensão do degradador SAR a outros inibidores de CDK para determinar se as suas descobertas eram transferíveis. Eles descobriram que os componentes moleculares que induziam a degradação das proteínas poderiam ser usados para converter vários inibidores diferentes em degradadores. Eles também identificaram certos substitutos que levaram a uma melhor degradação.
Primeira autora Katie Thomas, Ph.D. estudante da Divisão de Terapêutica do Câncer do ICR, disse:"Foi surpreendente ver que uma gama tão ampla de grupos poderia ser usada para induzir a degradação da ciclina K. Isso significa que a interface de interação entre CDK12 ligado ao degradador e DDB1 não precisam ser perfeitamente otimizados para que a degradação ocorra. Isso é promissor para o futuro do uso de colas monovalentes como modalidades terapêuticas - isso nos ajudará a progredir nas moléculas desde a descoberta até a otimização."
Degradadores são mais eficazes que inibidores
Os inibidores da proteína quinase têm sido utilizados no tratamento do câncer há mais de duas décadas. Eles atuam bloqueando a ação das proteínas quinases, enzimas que controlam a função das proteínas e podem levar ao crescimento celular desregulado se sofrerem mutação.
Embora estes tratamentos possam funcionar bem, existe o risco de o cancro se tornar resistente a eles. Isto ocorre porque os inibidores obstruem as proteínas relacionadas ao câncer em vez de destruí-las, e as células tumorais podem, às vezes, reativá-las.
Além disso, quando algumas proteínas quinases são bloqueadas por inibidores, a célula compensa usando outras quinases para realizar as mesmas ações.
Livrar-se inteiramente das proteínas através da degradação proteica elimina esses riscos.
Uma base para trabalhos futuros
Este estudo serve como ponto de partida para outros pesquisadores que buscam projetar colas moleculares, identificar alvos protéicos promissores para degradação e desenvolver novas moléculas que possam funcionar como terapias degradadoras.
Thomas disse:"Nossa hipótese é que outros inibidores de moléculas pequenas poderiam ser convertidos em degradadores por meio da adição de certos grupos. Nossa equipe está atualmente explorando se certos grupos podem ser unidos a outros tipos de inibidores de quinase para transformá-los em degradadores monovalentes. O trabalho também é em andamento para determinar se esses compostos podem degradar outras proteínas”.
Em teoria, assim que os investigadores obtiverem uma compreensão completa da SAR degradadora, será possível remover uma série de proteínas promotoras do cancro em diferentes tipos de cancro. Esta abordagem poderia, portanto, abrir a porta a novos tratamentos eficazes contra o cancro.
O autor correspondente, Dr. se podemos replicar esta abordagem para novos alvos. No entanto, acreditamos que a nossa investigação poderá permitir futuras descobertas de medicamentos”.
