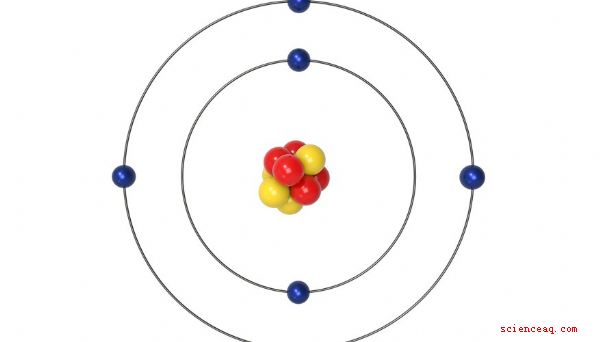
Um átomo é a menor quantidade possível de um elemento químico que ainda possui todas as propriedades desse elemento. Embora você possa tratá-los como pedaços discretos de matéria, eles, por sua vez, consistem em partículas mais fundamentais, o próton, o nêutron e o elétron. Alguma compreensão da estrutura do átomo é importante porque elétrons e prótons manifestam as cargas elétricas que conduzem tudo na química. Ao trabalhar com uma amostra de um elemento ou composto, você usa o número de Avogadro para calcular o número de átomos na amostra.
TL; DR (muito longo; não leu)
Para calcule o número de átomos em uma amostra, encontre a massa molar da substância, pese a amostra, divida o peso medido pela massa molar e multiplique pelo número de Avogadro.
Número de Avogadro e a toupeira
O número de Avogadro, também conhecido como constante de Avogadro, quantifica o número de átomos de carbono-12 em uma amostra de 12 gramas da substância. Como os átomos são muito pequenos, o número é muito grande, 6,022 x 10 ^ 23. Os químicos usam uma unidade chamada toupeira para medir uma quantidade de partículas igual ao número de Avogadro em uma amostra; por exemplo, uma mole de carbono-12 pesa 12 gramas; portanto, a massa molar de carbono-12 é de 12 gramas por mole. Observe que a massa molar dos átomos de nitrogênio é de 14,01 gramas por mole, mas como o gás nitrogênio tem dois átomos por molécula, a massa molar da molécula é de 28,02 gramas por mole.
Pesar a amostra
amostra em uma escala de grama e registre o peso. Ou, o peso já pode ter sido fornecido a você; Nesse caso, use essa figura. Por exemplo, após a pesagem, você descobre que uma amostra de alumínio pesa 6,00 gramas.
Pesquisa periódica da tabela
Encontre o elemento na tabela periódica e procure a massa atômica, geralmente o número sob o símbolo químico . Para amostras de elementos puros, massa atômica é a massa molar, que por sua vez é o número de gramas por mole. Por exemplo, a massa molar de alumínio é 26.982 g /mol.
Divida o peso por massa molar
Divida o peso grama da sua amostra pela massa molar da substância. O resultado desse cálculo é o número de mols de substância. Para continuar o exemplo, 6,00 gramas medidos da amostra de alumínio divididos por 26.982 g /mol resultam em 222 mols.
Multiplique pelo número de Avogadro
Multiplique o número de moles na sua amostra pelos átomos por mole, Número de Avogadro. O resultado é a resposta final - o número de átomos em sua amostra. No exemplo, você calculou 0,222 moles. Multiplique 0,222 moles por 6,022 x 10 ^ 23 átomos por mole para chegar à resposta, 1,34 x 10 ^ 23 átomos.