O átomo é a unidade mais básica de qualquer elemento que ainda mantém as propriedades desse elemento. Como os átomos são pequenos demais para serem vistos, sua estrutura sempre foi um mistério. Por milhares de anos, filósofos e cientistas propuseram teorias a respeito da composição dessa misteriosa partícula, com graus crescentes de sofisticação. Embora existissem muitos modelos, quatro principais levaram ao nosso atual conceito de átomo.
O modelo de pudim de ameixa
O chamado modelo de pudim de ameixa foi proposto pelo cientista J.J. Thomson em 1904. Este modelo foi concebido após a descoberta de Thomson do elétron como uma partícula discreta, mas antes que se entendesse que o átomo tinha um núcleo central. Nesse modelo, o átomo é uma bola de carga positiva - o pudim - na qual os elétrons - as ameixas - estão localizados. Os elétrons giram em caminhos circulares definidos dentro da bolha positiva que compõe a maioria do átomo.
Modelo Planetário
Essa teoria foi proposta pelo químico vencedor do Prêmio Nobel Ernest Rutherford em 1911 e às vezes é chamada de Modelo de Rutherford. Com base em experimentos que mostraram que o átomo parecia conter um pequeno núcleo de carga positiva, Rutherford postulou que o átomo consistia em um núcleo pequeno, denso e carregado positivamente, em torno do qual elétrons orbitaram em anéis circulares. Esse modelo foi um dos primeiros a propor a estranha idéia de que os átomos são compostos principalmente de espaços vazios pelos quais os elétrons se movem.
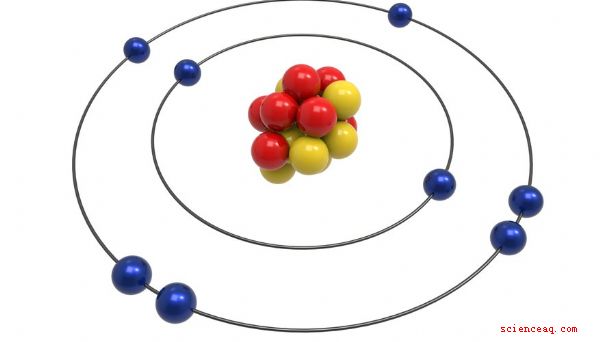
Modelo de Bohr
O modelo de Bohr foi desenvolvido por Neils Bohr, físico de Dinamarca, que recebeu o prêmio Nobel por seu trabalho no átomo. De certa forma, é um aprimoramento mais sofisticado do modelo de Rutherford. Bohr propôs, assim como Rutherford, que o átomo tivesse um núcleo pequeno e positivo onde residia a maior parte de sua massa. Ele afirmou que os elétrons orbitaram esse núcleo como planetas ao redor do sol. A principal melhoria do modelo de Bohr foi que os elétrons estavam confinados para definir órbitas ao redor do núcleo, cada um com um nível de energia específico, o que explicava observações experimentais como radiação eletromagnética. Atualmente, o modelo é o modelo mais sofisticado e amplamente aceito do átomo. Ele mantém o conceito de núcleo dos modelos de Bohr e Rutherford, mas introduz uma definição diferente do movimento dos elétrons ao redor do núcleo. O movimento de elétrons ao redor do núcleo neste modelo é definido por regiões onde há uma maior probabilidade de encontrar o elétron a qualquer momento. Essas regiões de probabilidade ao redor do núcleo estão associadas a níveis específicos de energia e assumem uma variedade de formas estranhas à medida que a energia dos elétrons aumenta.