Resumo gráfico. Crédito:Jornal da Sociedade Americana de Química (2022). DOI:10.1021/jacs.1c12407
Pesquisadores da Universidade de East Anglia identificaram uma nova classe de enzima envolvida no controle do estresse em bactérias.
Todos os organismos, de humanos a bactérias, devem ser capazes de responder a uma ampla gama de estresses que resultam de mudanças em seu ambiente.
Comum entre eles são os chamados estresses oxidativos e nitrosativos, que ocorrem quando um organismo é exposto a altas concentrações de espécies reativas de oxigênio ou nitrogênio reativo, respectivamente. Quando isso acontece, os componentes frágeis da célula são danificados, levando à perda de função e, em alguns casos, à morte celular.
Sem surpresa, os organismos desenvolveram uma infinidade de sistemas de resposta ao estresse que detectam e aliviam estresses específicos.
Aglomerados de ferro-enxofre, que consistem em ferro e enxofre inorgânico, são encontrados em todos os tipos de células, onde desempenham papéis essenciais em uma ampla gama de processos celulares. Por serem tão reativos, muitas vezes são os primeiros componentes celulares a serem danificados sob condições de estresse.
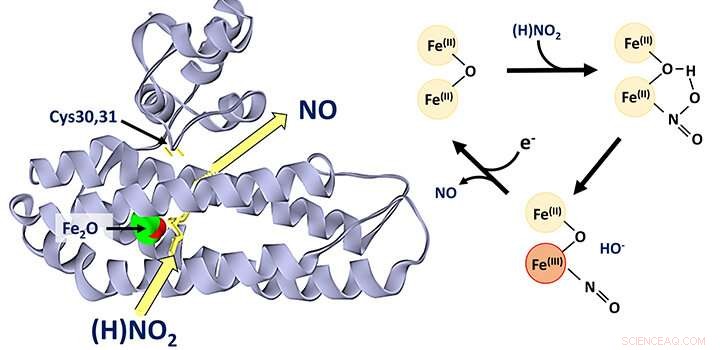
Acredita-se que a proteína di-ferro YtfE, amplamente encontrada em bactérias, funcione diretamente no reparo de aglomerados de ferro-enxofre que foram danificados sob condições de estresse. Esta atividade foi variavelmente proposta para envolver a doação de ferro para a reconstrução de aglomerados de ferro-enxofre, ou a remoção de óxido nítrico (NO) de aglomerados danificados.
Recentemente, surgiram novas evidências de estudos da função do YtfE em células que sugeriram que sua atividade está associada a um aumento, e não a uma diminuição, na concentração de NO. Isso levou os pesquisadores da Escola de Química a reexaminar a função do YtfE.
A equipe, liderada pelo Dr. Jason Crack e Prof Nick Le Brun, e envolvendo o laboratório do Dr. Fraser MacMillan, bem como pesquisadores da Universidade de Birmingham e da Universidade de Sheffield, descobriram que YtfE é um novo tipo de enzima nitrito redutase que produz NO.
Eles mostraram que YtfE não remove eficientemente NO de aglomerados de ferro-enxofre danificados, nem é um doador efetivo de ferro para montagem de aglomerados.
A produção catalisada por YtfE de NO tóxico a partir de nitrito (NO
2
-
) pode parecer estranho, mas YtfE é co-regulado com outra enzima, chamada Hcp, que funciona para desintoxicar NO (através de sua redução a óxido nitroso, N
2 O).
A via de desintoxicação YtfE/Hcp acoplada representa um meio eficaz pelo qual a célula lida com níveis tóxicos de nitrito que podem ocorrer em condições anaeróbicas.
A equipe usou uma variedade de abordagens, incluindo espectroscopia de proteínas in vivo e genética in vitro e espectrometria de massa, para obter informações detalhadas sobre o mecanismo pelo qual o YtfE gera NO a partir de nitrito.
O trabalho esclarece o papel de uma proteína que intriga os pesquisadores há muito tempo, demonstrando que o YtfE é um ator fundamental para o gerenciamento do estresse em condições de respiração anaeróbica, como as encontradas no intestino humano ou ao infectar um hospedeiro humano.
O trabalho é publicado esta semana no
Journal of the American Chemical Society .
+ Explorar mais Os pesquisadores sugerem que os aglomerados de [FeS] atuam como fusíveis biológicos em muitas proteínas envolvidas na resposta imune
