
Figura 1. Uma nova técnica para observar membranas de células vivas para AFM usando membrana porosa de nitreto de silício (MPM). (a) O aparecimento de MPM. (b) Os buracos do MPM observados pelo AFM. (c) O MPM quando colocado na câmara para observação. (d) Esquema de observação da superfície celular AFM usando MPM. Crédito:Universidade de Kanazawa
Pesquisadores da Universidade de Kanazawa relatam em
Biologia da Comunicação que o uso de produtos químicos comuns para fixar amostras de células vivas para estudos de microscopia faz com que as proteínas da membrana se agreguem.
Para investigações histológicas de tecidos biológicos, ou seja, estudos anatômicos sob o microscópio, as amostras geralmente são fixadas para evitar que se decomponham. A fixação geralmente é feita por imersão ou perfusão da amostra em um produto químico – aldeídos e álcoois são fixadores comuns. Especulou-se que as proteínas de membrana que se movem até certo ponto na membrana celular podem formar agregados durante a fixação. No entanto, estudos detalhados da superfície celular com resolução em escala nanométrica são necessários para obter informações definitivas sobre esse possível problema. Agora, Takehiko Ichikawa e colegas da Universidade de Kanazawa realizaram estudos de microscopia de força atômica (AFM) de superfícies de células de mamíferos vivos. Ao comparar amostras não fixadas e fixadas, eles descobriram que a fixação realmente leva a mudanças estruturais.
Os pesquisadores desenvolveram um método de utilização de membrana microporosa de nitreto de silício (MPM), usada em microscopia eletrônica de transmissão (Figura 1), para imagens de AFM. É importante ressaltar que o MPM pode tornar a superfície da célula plana e evitar flutuações apoiando a área fora da área de observação. Em imagens AFM das superfícies das células de câncer de cólon cultivadas em MPM, estruturas biomoleculares nas membranas celulares mostraram-se como saliências com um tamanho típico de alguns nanômetros (Figura 2 superfície da célula viva).
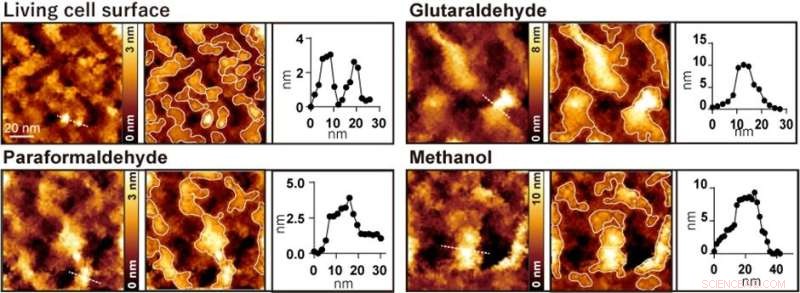
Figura 2. Observação da superfície celular AFM antes e após o tratamento com glutaraldeído, paraformaldeído e metanol, respectivamente. A imagem da esquerda é uma imagem AFM, a imagem central é uma imagem AFM com as saliências emolduradas e a imagem direita é um perfil de altura ao longo da linha pontilhada na imagem esquerda. Crédito:Universidade de Kanazawa
Quando as células foram tratadas com fixadores comumente usados, como paraformaldeído, glutaraldeído e metanol, algumas estruturas nanométricas desapareceram, e apenas grandes saliências com diâmetros variando de 20 a 100 nanômetros foram observadas (Figura 2). Os pesquisadores realizaram vários experimentos de fluorescência e concluíram que grandes saliências observadas após a fixação foram formadas pela agregação de proteínas de membrana.
O estudo demonstra que os agregados observados são artefatos resultantes do processo de fixação. Isso deve exigir cautela entre a comunidade de pesquisadores que trabalham com fixadores químicos. Citando Ichikawa e colegas:"Os pesquisadores que observam aglomerados em nanoescala também devem ter cuidado ao interpretar seus resultados experimentais ao usar células fixas. Recomendamos que os pesquisadores usem células vivas o máximo possível para evitar o efeito de fixação ao investigar aglomerados em nanoescala".
O princípio geral por trás da microscopia de força atômica (AFM) é fazer com que uma ponta muito pequena escaneie a superfície de uma amostra. Durante esta varredura horizontal (xy), a ponta, que está presa a um pequeno cantilever, segue o perfil vertical (z) da amostra, induzindo uma força no cantilever que pode ser medida. A magnitude da força na posição xy pode ser relacionada ao valor de z; os dados xyz gerados durante uma varredura resultam em um mapa de altura fornecendo informações estruturais sobre a amostra investigada. AFM não é afetado pelo limite de difração devido ao uso de luz ou feixes de elétrons e pode observar a topografia da superfície intacta com alta resolução.
+ Explorar mais Atribuindo recursos móveis em microscopia de força atômica de alta velocidade

