 p A interpretação de um artista da barreira de energia que um átomo de flúor reagente deve cruzar ao colidir com uma molécula de fluorometil em seu caminho para formar um produto como resultado de uma reação química. Pesquisadores da Universidade de Toronto observaram a ejeção colinear "knock-on" do produto da reação (circulado em azul) na continuação da direção da molécula do reagente de entrada (circulado em vermelho). Crédito:Lydie Leung
p A interpretação de um artista da barreira de energia que um átomo de flúor reagente deve cruzar ao colidir com uma molécula de fluorometil em seu caminho para formar um produto como resultado de uma reação química. Pesquisadores da Universidade de Toronto observaram a ejeção colinear "knock-on" do produto da reação (circulado em azul) na continuação da direção da molécula do reagente de entrada (circulado em vermelho). Crédito:Lydie Leung
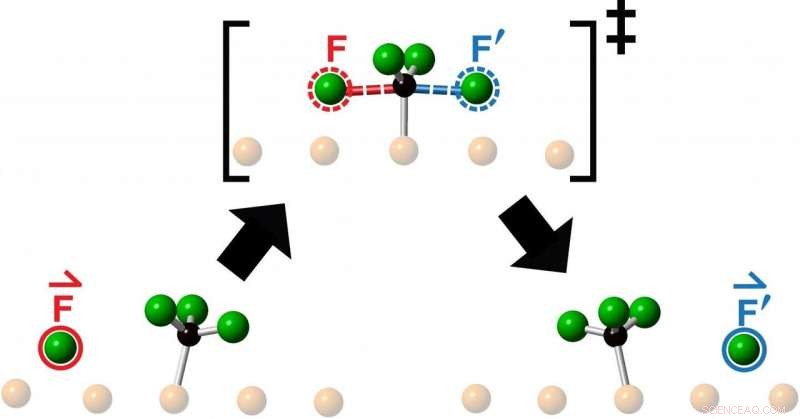
p Pesquisa por uma equipe de químicos da Universidade de Toronto, liderado pelo pesquisador ganhador do Prêmio Nobel John Polanyi, está lançando uma nova luz sobre o comportamento das moléculas conforme elas colidem e trocam átomos durante a reação química. A descoberta lança dúvidas sobre um modelo teórico de 90 anos do comportamento do "estado de transição", intermediário entre reagentes e produtos em reações químicas, abrindo uma nova área de pesquisa. p Os pesquisadores estudaram as colisões obtidas ao lançar um átomo de flúor no centro de uma molécula de fluorometil - composta de um átomo de carbono e três átomos de flúor - e observaram a reação resultante usando microscopia de varredura em túnel. O que eles viram após cada colisão foi a ejeção de um novo átomo de flúor movendo-se colinearmente ao longo da continuação da direção de aproximação do átomo de flúor que entrava.
p "Os químicos jogam moléculas em outras moléculas o tempo todo para ver o que acontece ou na esperança de fazer algo novo, "diz Polanyi, Professor universitário do Departamento de Química da Faculdade de Artes e Ciências da U of T e autor sênior de um estudo publicado este mês em
Química da Comunicação . "Descobrimos que mirar uma molécula reagente no centro de uma molécula alvo, restringe o movimento do produto emergente a uma única linha, como se o produto tivesse sido diretamente 'batido'. A observação surpreendente de que o produto da reação surge em linha reta, movendo-se na mesma direção que o átomo reagente de entrada, sugere que os movimentos que levam à reação se assemelham a uma simples transferência de impulso para a frente.
p "A conservação do momento linear que observamos aqui sugere um 'estado de transição' de curta duração, em vez da visão anterior de que há tempo suficiente para a randomização do movimento. Newton iria, Eu penso, ficamos satisfeitos que a natureza permite um simples evento indireto para descrever algo tão complexo como uma reação química, "diz Polanyi.
 p O estudante de graduação da Universidade de Toronto, Matthew Timm, prepara um microscópio de tunelamento para um experimento que controla o resultado de uma reação química selecionando o parâmetro de impacto das colisões moleculares. Crédito:Diana Tyszko
p O estudante de graduação da Universidade de Toronto, Matthew Timm, prepara um microscópio de tunelamento para um experimento que controla o resultado de uma reação química selecionando o parâmetro de impacto das colisões moleculares. Crédito:Diana Tyszko
p O time, que incluiu pesquisadora associada sênior Lydie Leung, estudante de graduação Matthew Timm e Ph.D. graduado Kelvin Anggara, havia estabelecido anteriormente os meios para controlar se uma molécula lançada em direção a outra colide frontalmente com seu alvo ou erre em uma determinada quantidade - uma quantidade conhecida como parâmetro de impacto. Quanto maior o parâmetro de impacto, quanto maior a distância pela qual a molécula que chega perde a molécula alvo. Para o novo trabalho, os pesquisadores empregaram um parâmetro de impacto de zero para dar uma colisão frontal.
p "Chamamos esse novo tipo de reação química unidimensional de 'knock-on', uma vez que descobrimos que o produto é batido ao longo da continuação da direção da abordagem do reagente, "diz Polanyi." Os movimentos lembram o golpe das bolas de aço de um berço de Newton. As bolas de aço do berço não passam uma pela outra, mas transfere de forma eficiente o momento ao longo de uma única linha.
p "De forma similar, nossas reações em cadeia transferem energia ao longo de fileiras de moléculas, favorecendo assim uma reação em cadeia. Esta conservação de energia de reação em química indireta pode ser útil à medida que o mundo se move em direção à conservação de energia. Por enquanto, serve como um exemplo de reação química em sua forma mais simples. "
p É sabido há bem mais de um século que existe uma barreira de energia que os reagentes químicos devem cruzar em seu caminho para formar produtos de reação. Um estado de transição energizado existe brevemente no topo da barreira em uma configuração crítica - nenhum estado de transição, nenhuma reação.
p Polanyi diz que a observação do 'knock-on' colinear fornece uma visão sobre o complexo de colisão reativo, que dura cerca de um milionésimo de segundo. "Nossos resultados nos dizem claramente que o estado de transição no topo da barreira de energia dura tão pouco tempo que não consegue embaralhar totalmente seus momentos. Em vez disso, lembra a direção de onde veio o átomo de flúor de ataque. "
p Na década de 1930, os químicos começaram a calcular a probabilidade de formar um estado de transição supondo que ele embaralha sua energia, como uma molécula quente. Embora fosse uma suposição, parecia bem estabelecido e deu origem à estatística "teoria do estado de transição" das taxas de reação. Este ainda é o método preferido para calcular as taxas de reação.
p "Agora, com a capacidade de observar os reagentes e os produtos em nível molecular, pode-se ver precisamente como os reagentes se aproximam e, posteriormente, como os produtos se separam, "Polanyi diz." Mas isso vai de encontro ao modelo estatístico clássico de 90 anos. Se a energia e o momento fossem randomizados no estado de transição a quente, os produtos não exibiriam uma memória clara da direção de abordagem dos reagentes. A randomização de energia funcionaria para apagar essa memória. "
p Os pesquisadores dizem que o movimento direcional observado dos produtos da reação favorece um modelo determinístico do estado de transição para substituir o modelo estatístico de longa data. Adicionalmente, a dinâmica de reação observada permite que a energia do reagente seja passada adiante em colisões colineares sucessivas.

