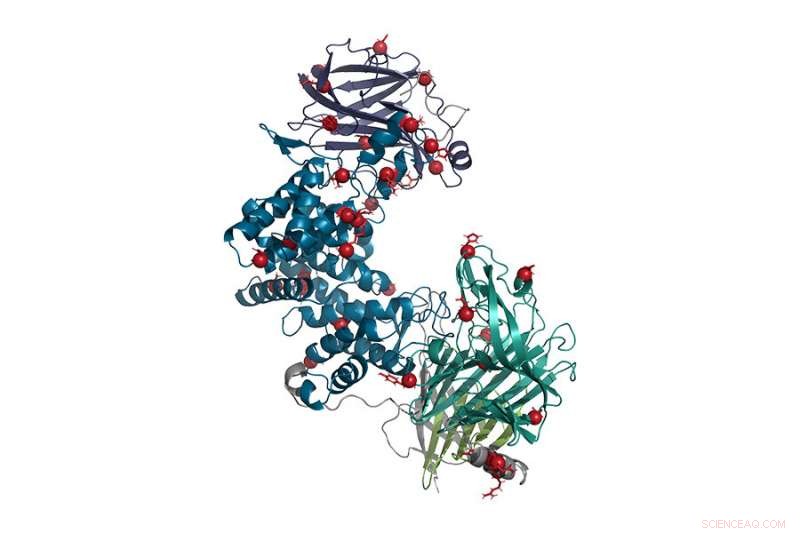
Nesta representação da enzima condroitinase ABC, mutações pontuais são representadas por bolas vermelhas. Esta forma reprojetada da enzima é mais estável e mais ativa do que o tipo selvagem e pode ser usada para ajudar a reverter danos nos nervos causados por lesão da medula espinhal ou derrame. Crédito:Hettiaratchi, O'Meara et al., 2020. DOI:10.1126 / sciadv.abc6378 Este trabalho está licenciado sob CC BY-NC
Uma equipe de pesquisadores da University of Toronto Engineering e da University of Michigan redesenhou e aprimorou uma enzima natural que se mostra promissora na promoção do crescimento do tecido nervoso após a lesão.
Sua nova versão é mais estável do que a proteína que ocorre na natureza, e pode levar a novos tratamentos para reverter o dano nervoso causado por lesão traumática ou acidente vascular cerebral.
"O AVC é a principal causa de deficiência no Canadá e a terceira principal causa de morte, "diz a professora de engenharia da Universidade de Toronto Molly Shoichet, autor sênior em um novo estudo publicado na revista Avanços da Ciência .
"Um dos maiores desafios para a cura após esse tipo de lesão nervosa é a formação de uma cicatriz glial."
Uma cicatriz glial é formada por células e substâncias bioquímicas que se unem firmemente ao redor do nervo danificado. A curto prazo, este ambiente protetor protege as células nervosas de novas lesões, mas, a longo prazo, pode inibir o reparo do nervo.
Cerca de duas décadas atrás, os cientistas descobriram que uma enzima natural conhecida como condroitinase ABC - produzida por uma bactéria chamada Proteus vulgaris - pode degradar seletivamente algumas das biomoléculas que constituem a cicatriz glial.
Ao mudar o ambiente ao redor do nervo danificado, A condroitinase ABC demonstrou promover o crescimento de células nervosas. Em modelos animais, pode até levar à recuperação de alguma função perdida.
Mas o progresso tem sido limitado pelo fato de que a condroitinase ABC não é muito estável nos locais onde os pesquisadores desejam usá-la.
"É estável o suficiente para o ambiente em que as bactérias vivem, mas dentro do corpo é muito frágil, "diz Shoichet." Agrega, ou aglomeram-se, o que faz com que perca atividade. Isso acontece mais rápido à temperatura corporal do que à temperatura ambiente. Também é difícil administrar a condroitinase ABC porque é suscetível à degradação química e às forças de cisalhamento normalmente usadas nas formulações. "
Várias equipes, incluindo Shoichet, experimentaram técnicas para superar essa instabilidade. Alguns tentaram envolver a enzima em polímeros biocompatíveis ou anexá-la a nanopartículas para evitar que se agregasse. Outros tentaram infundi-lo no tecido danificado lenta e gradualmente, a fim de garantir uma concentração consistente no local da lesão.
Mas todas essas abordagens são meros curativos - elas não abordam o problema fundamental da instabilidade.
Em seu último artigo, Shoichet e seus colaboradores tentaram uma nova abordagem:eles alteraram a estrutura bioquímica da enzima para criar uma versão mais estável.
"Como qualquer proteína, a condroitinase ABC é composta de blocos de construção chamados aminoácidos, "diz Shoichet." Usamos química computacional para prever o efeito da troca de alguns blocos de construção por outros, com o objetivo de aumentar a estabilidade geral, mantendo ou melhorando a atividade da enzima. "
"A ideia era provavelmente um pouco maluca, porque assim como na natureza, uma única mutação ruim pode destruir a estrutura, "diz Mathew O'Meara, professor de medicina computacional e bioinformática da Universidade de Michigan, e co-autor principal do novo artigo.
"Existem mais de 1, 000 elos da cadeia que forma esta enzima, e para cada link você tem 20 aminoácidos para escolher, "diz ele." Existem muitas opções para simular todas elas. "
Para restringir o espaço de pesquisa, a equipe aplicou algoritmos de computador que imitam os tipos de substituições de aminoácidos encontrados em organismos reais. Esta abordagem - conhecida como projeto de consenso - produz formas mutantes da enzima que não existem na natureza, mas são plausivelmente como aqueles que o fazem.
No fim, a equipe acabou com três novas formas candidatas da enzima que foram produzidas e testadas em laboratório. Todos os três eram mais estáveis do que o tipo selvagem, mas apenas um, que teve 37 substituições de aminoácidos em mais de 1, 000 elos da cadeia, era mais estável e mais ativo.
"A condroitinase ABC do tipo selvagem perde a maior parte de sua atividade em 24 horas, considerando que nossa enzima reprojetada está ativa por sete dias, "diz Marian Hettiaratchi, o outro co-autor principal do artigo. Um ex-pós-doutorado no laboratório de Shoichet, Hettiaratchi é agora professor de bioengenharia no Campus Phil e Penny Knight da Universidade de Oregon para Acelerar o Impacto Científico.
"Esta é uma grande diferença. Espera-se que nossa enzima aprimorada degradar de forma ainda mais eficaz a cicatriz glial do que a versão comumente usada por outros grupos de pesquisa, "diz Hettiaratchi.
A próxima etapa será implantar a enzima nos mesmos tipos de experimentos em que o tipo selvagem foi usado anteriormente.
“Quando começamos este projeto, fomos aconselhados a não tentar, pois seria como procurar uma agulha em um palheiro, "diz Shoichet." Tendo encontrado aquela agulha, estamos investigando essa forma da enzima em nossos modelos de acidente vascular cerebral e lesão da medula espinhal para entender melhor seu potencial como agente terapêutico, sozinho ou em combinação com outras estratégias. "
Shoichet aponta a natureza multidisciplinar do projeto como uma chave para o seu sucesso.
"Pudemos aproveitar a experiência complementar dos autores para concretizar este projeto, e ficamos chocados e muito felizes com o sucesso, "ela diz." Foi muito além de nossas expectativas. "