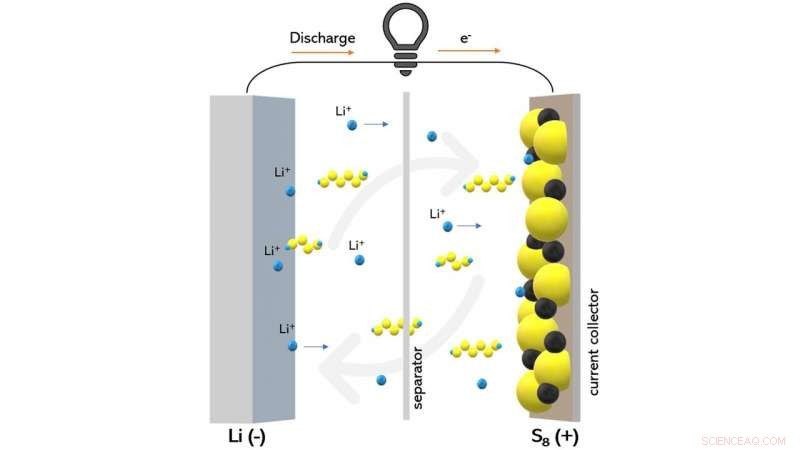
Este diagrama mostra uma bateria de lítio-enxofre durante a descarga. Os cientistas foram capazes de observar como um certo tipo de material eletrolítico pode reduzir o transporte de compostos de polissulfeto (mostrados como cadeias amarelas e azuis) que prejudicam o desempenho da bateria. Crédito:Wikipedia / Creative Commons
As baterias de íon-lítio representam a maioria das baterias em eletrônicos de consumo e veículos elétricos. Hoje, os cientistas estão procurando por novos produtos químicos que possam melhorar a densidade de energia e o desempenho das baterias além das baterias convencionais de íon-lítio.
Um tipo dessas baterias, chamadas baterias de lítio-enxofre, poderia oferecer mais densidade de energia e menor custo do que a bateria de íon-lítio tradicional de grafite / óxido de metal. Contudo, seu desempenho é frequentemente prejudicado por uma reação parasitária que ocorre dentro da bateria que a impede de funcionar de forma eficiente.
Agora, em um novo estudo, cientistas do Laboratório Nacional de Argonne do Departamento de Energia dos EUA descobriram como uma certa classe de material eletrolítico pode reduzir a frequência dessa reação, potencialmente pavimentando o caminho para baterias de lítio-enxofre mais eficazes.
Quando uma bateria de lítio-enxofre é carregada, uma reação secundária inevitável chamada transporte de polissulfeto de lítio freqüentemente ocorre. Conforme a bateria carrega, sulfeto de lítio é convertido em enxofre no cátodo, mas alguns compostos de lítio-enxofre que não estão completamente oxidados podem se dissolver do cátodo para o eletrólito - a região líquida da bateria que separa os dois eletrodos.
Neste ponto, os compostos de lítio-enxofre podem se difundir e tornar-se reduzidos no ânodo e oxidar de volta no cátodo. Esse processo pode ser repetido indefinidamente de uma forma que desperdiça a carga da bateria sem colocá-la para funcionar.
"Com a lançadeira de polissulfeto, você não está obtendo nada da bateria, exceto aquecê-la, "disse o químico de Argonne Chi Cheung Su, um autor do estudo. "Em termos eletroquímicos, é como voar de Nova York a Los Angeles, mas ficar preso viajando de um lado para o outro entre Chicago e Denver. "
Uma grande parte da razão para o início do transporte de polissulfetos acontece porque os polissulfetos são capazes de se dissolver facilmente em um eletrólito contendo uma mistura de solvente de dois compostos chamados dioxolano (DOL) e dimetoxietano (DME). "Existem dois problemas que precisamos resolver simultaneamente - ter baixa solubilidade e alta condutividade, "Su disse." Ao alcançar ambos, podemos trazer essas baterias para mais perto da realidade. "
De acordo com Su, nos últimos cinco anos, mais ou menos, assistimos ao desenvolvimento de um novo tipo de material eletrolítico que poderia resolver esses dois problemas. Este material, chamado de hidrofluoroéter, ou HFE, tem uma capacidade de solvatação muito menor, embora ainda mantenha geralmente uma boa condutividade. "O primeiro passo para o lítio chegar ao ânodo envolve dissolvê-lo no eletrólito, "disse ele." Como a água é um solvente muito bom para o sal de cozinha, O DME é um solvente muito bom para o lítio. Mas com HFEs é como tentar dissolver o sal na gasolina. "
Embora esta propriedade geral dos HFEs seja conhecida há vários anos, Su e seus colegas descobriram uma maneira geral de prever o comportamento de solvatação e a condutividade dessa classe de moléculas. Primeiro, eles os dividiram em três tipos, dependendo de suas estruturas químicas. Ao medir o desempenho dos eletrólitos, os pesquisadores notaram uma desvantagem importante:os produtos químicos que mostraram o comportamento de solvatação mais baixo e a menor quantidade de transporte de polissulfeto também tinham condutividades mais baixas.
"Isso mostra que ainda não há solução mágica para baterias de lítio-enxofre, e que ainda precisamos continuar a encontrar maneiras de melhorar os produtos químicos que temos, "Su disse.
Um artigo baseado na pesquisa, "Uma regra de seleção para o co-solvente eletrolítico de hidrofluoroéter:estabelecendo uma relação linear de energia livre em baterias de lítio-enxofre, "apareceu na edição de 13 de maio da Angewandte Chemie .