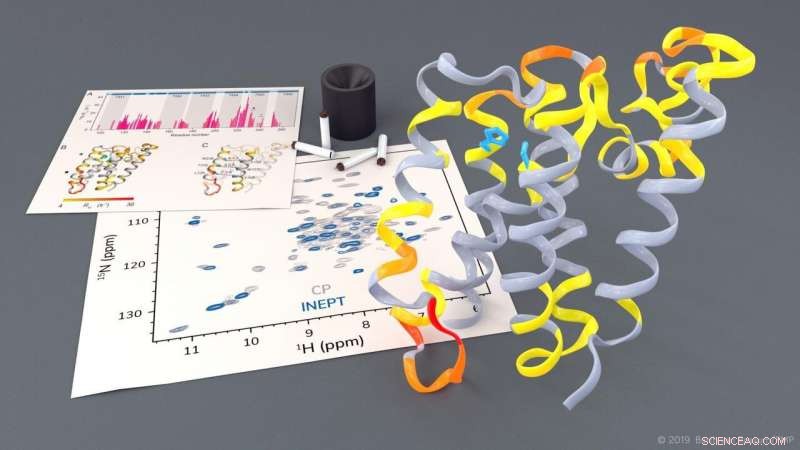
Investigação da protease romboide GlpG por NMR de estado sólido. Crédito:Barth van Rossum, FMP
As proteases romboides são proteínas de membrana clinicamente relevantes que desempenham um papel fundamental em várias doenças. Usando espectroscopia de NMR de estado sólido, pesquisadores da Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) de Berlim agora podem observar proteases romboides em um ambiente de lipídio nativo em funcionamento. As imagens dinâmicas obtidas serão úteis para o desenvolvimento de novos medicamentos para doenças como Parkinson e malária. Os resultados deste trabalho pioneiro acabam de ser publicados no Jornal da American Chemical Society .
Dezenas de milhares de proteínas estão trabalhando em nossas células, o tempo todo. Alguns desses trabalhadores industriosos sentam-se na membrana celular, entre eles a família das proteases romboides. Dado que essas proteases intramembrana estão envolvidas em muitos processos biológicos, e também desempenham um papel fundamental em doenças como o mal de Parkinson, diabetes, câncer e malária, eles são altamente relevantes clinicamente.
Anteriormente, tinha sido possível visualizar proteases romboides usando cristalografia de raios-X. Contudo, este método só foi capaz de fornecer imagens estáticas de proteínas em um ambiente artificial. Portanto, permaneceu de grande interesse ver o que acontece na membrana celular, onde as proteínas realizam sua tarefa principal, que está clivando outras proteínas de membrana, desencadeando uma cascata de sinalização.
O tão suspeito portão que se abre existe de fato
O grupo de pesquisa liderado pelo professor Adam Lange do Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) agora pode investigar este processo altamente complexo, pela primeira vez usando espectroscopia de NMR de estado sólido em um ambiente de tipo nativo. Os pesquisadores foram capazes de observar como certas partes da protease se movem. Eles também notaram que, a fim de clivar outras proteínas, um portão se abre brevemente para permitir que essas proteínas substrato entrem no centro ativo da protease.
Achados relevantes para interferência farmacológica
O projeto, realizado dentro do Cluster de Excelência UniSysCat, estabelece uma base para uma caracterização ainda melhor de proteases romboides. O que é mais:o conhecimento adquirido será útil para os pesquisadores investigarem como eles podem influenciar farmacologicamente as proteínas de membrana clinicamente relevantes. Além disso, Lange e sua equipe agora querem pesquisar substâncias para inibir proteases romboides errantes.