Crédito:American Chemical Society
Quer se trate de bolo de chocolate ou molho de massa, a sensação de doçura desempenha um papel importante na dieta humana e na percepção de outros sabores. Embora muito se saiba sobre as proteínas individuais que sinalizam "doce, "não se sabe muito sobre como as proteínas funcionam juntas como um receptor para realizar essa façanha. Agora, no ACS Chemical Neuroscience , pesquisadores relatam uma análise molecular do receptor, o que um dia poderia levar a alimentos com um sabor melhor.
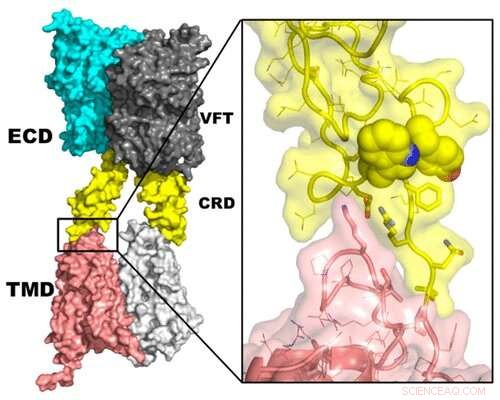
Os receptores de sabor são membros de uma família de receptores acoplados à proteína G que comunicam informações às células do corpo. Em particular, as proteínas T1R2 e T1R3 formam um complexo conhecido como receptor doce que é responsável pela percepção das moléculas, como açúcares naturais, adoçantes artificiais, e algumas proteínas e aminoácidos. Embora recentemente tenham sido obtidas informações sobre a estrutura e função do receptor, o layout exato das proteínas no complexo e seu processo de ativação não são totalmente claros. Então, Ruhong Zhou e colegas começaram a desenvolver e analisar estruturas teóricas do receptor.
Os pesquisadores usaram dados existentes sobre as proteínas T1R2 e T1R3 para gerar modelos de computador detalhados de cada estrutura. Em seguida, eles criaram e analisaram modelos das proteínas juntas no complexo completo, e conduziu estudos aprofundados em dois segmentos específicos:uma parte que está dentro da membrana celular e outra que está fora da célula. De lá, o grupo realizou simulações e aprendeu como a arquitetura do receptor pode mudar quando produtos químicos, como sódio e colesterol, vincular-se a ele. Além disso, configurações prováveis das estruturas do T1R2 e do T1R3 foram reveladas em relação uma à outra quando em um complexo. Esses modelos podem servir como base para futuras experiências sobre como o receptor de doce afeta a nutrição, desenvolvimento de medicamentos e saúde humana em geral, dizem os pesquisadores.