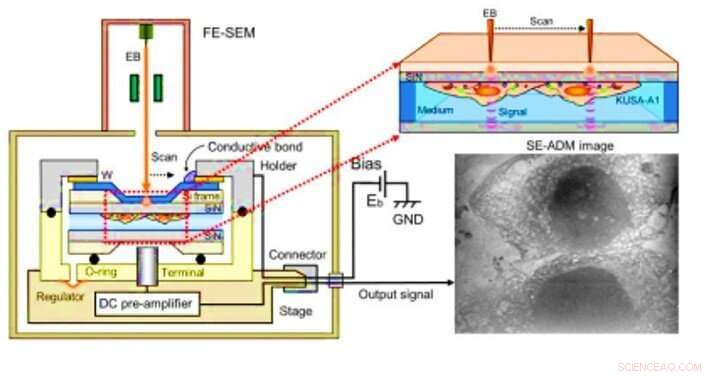
Microscopia dielétrica assistida por elétrons de varredura (SE-ADM) observação de osteoblastos. (A) SE-ADM de alta resolução configurado para observação de osteoblastos. O suporte de amostra líquida, incluindo osteoblastos, é montado no estágio conectado ao pré-amplificador, que é introduzido na câmara SEM da amostra. O feixe de elétrons de varredura é aplicado ao filme de SiN revestido com W a uma baixa tensão de aceleração. O terminal de medição sob o suporte detecta sinais elétricos através de amostras líquidas. Estruturas intracelulares claras são visíveis (imagem à direita). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
A mineralização é mediada por osteoblastos, que secretam precursores minerais através de vesículas de matriz (MVs) como um processo fundamental em vertebrados. As vesículas são ricas em cálcio e fosfato, contendo materiais orgânicos, como proteínas ácidas. Em um novo estudo agora publicado em Avanços da Ciência , Tomoaki Iwayama e colegas dos departamentos de periodontologia, pesquisa biomédica, ciência oral, o desenvolvimento de biomateriais e da anatomia oral usou microscopia dielétrica assistida por elétrons de varredura (SE-ADM) e microscopia de super-resolução (SRM) para avaliar osteoblastos vivos durante condições de mineralização em resolução de nível nano. Eles descobriram que as vesículas contendo cálcio são corpos multivesiculares contendo nanovesículas mineralizantes ou vesículas de matriz (MVs). De acordo com as observações, as MVs podem ser transportadas junto com os lisossomos e secretadas por exocitose. Iwayama et al. apresentaram provas de que os lisossomos poderiam transportar fosfato de cálcio amorfo em células de osteoblastos mineralizantes.
Durante o processo fisiológico de mineralização óssea, a deposição de cristais de fosfato de cálcio ocorre na matriz extracelular como processo fundamental em todos os vertebrados. Em 1967, os biólogos Clarke Anderson e Ermanno Bonucci, partículas relacionadas a minerais visualizadas individualmente no espaço extracelular usando microscopia eletrônica (EM). Os cientistas mais tarde reconheceram essas partículas como nanovesículas mineralizantes ou vesículas de matriz (MVs). Durante os últimos 50 anos de estudos EM em MVs, biólogos têm se esforçado para entender o mecanismo de formação e secreção de MV, que permanece amplamente desconhecido.
Esclarecer o processo de mineralização de células vivas com EM é um desafio, pois a preparação da amostra para EM requer etapas de fixação química e desidratação alcoólica. As etapas podem induzir artefatos e até mesmo dissolver ou remover precursores minerais instáveis, deixando um andaime orgânico conhecido como "fantasma de cristal". Embora os cientistas tenham usado com sucesso o processo de EM usando tecido fixo e desidratado para visualizar a estrutura das fibrilas de colágeno mineralizadas no osso, para estudar precursores minerais, eles devem empregar processos crio-EM para evitar a desidratação e facilitar o custo, resfriamento extremamente rápido com amostras pequenas.
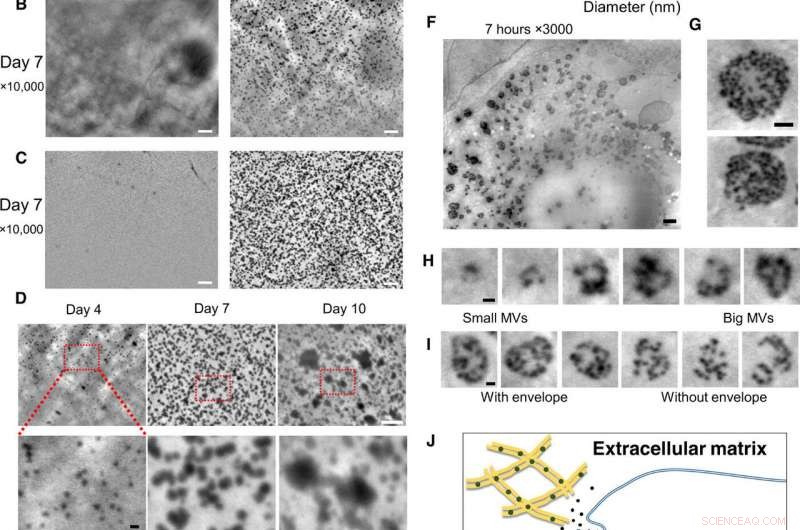
Observação em nanoescala de osteoblastos vivos em meios de cultura, usando o sistema SE-ADM. (A) Imagens SE-ADM representativas de alta resolução de osteoblastos cultivados com ou sem meio osteogênico por 2 dias. Partículas pretas eram evidentes apenas quando cultivadas em meio osteogênico (direita, quadrado na parte inferior). (B) Imagens SE-ADM representativas de alta resolução de osteoblastos cultivados com ou sem meio osteogênico por 7 dias. Existem muitas partículas pretas quando cultivadas em meio osteogênico (direita). (C) Imagens SE-ADM representativas de alta resolução do filme de SiN após a remoção das células. Na mídia normal, nenhuma partícula é observada (esquerda). A imagem do filme após a remoção das células cultivadas em meio osteogênico mostra muitas partículas pretas claras dispersas em toda a área (direita). (D) Comparação de imagens de partículas durante 4 a 10 dias de cultura em meio osteogênico. O tamanho das partículas aumentou gradualmente. (E) Distribuição do tamanho de partícula medido durante 4 a 10 dias de cultivo em meio osteogênico. Aproximadamente 900 a 1100 partículas por ponto de tempo foram medidas e plotadas como um histograma. (F) Imagens SE-ADM representativas de alta resolução de osteoblastos cultivados com meio osteogênico por 7 horas. (G) MVBs têm envelopes cinza claro. (H) Cortar imagens de vários tamanhos de MVB, incluindo partículas. (I) Comparação de MVBs com ou sem envelope cinza. (J) Visão esquemática da formação intracelular e transporte de MVB em osteoblastos mineralizantes. Barras de escala, 1 μm em (A) a (C) e (F); 500 nm em (G); 200 nm em (D, fundo), (H), e eu). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
Para superar essas limitações no presente trabalho, Iwayama et al. usou um novo sistema microscópico conhecido como microscopia dielétrica assistida por elétrons de varredura (SE-ADM). O método já havia alcançado resolução em nanoescala e imagens de alto contraste para células de mamíferos em meio aquoso sem coloração. Os cientistas usaram a mesma técnica (alta resolução SE-ADM) para explorar a possibilidade de visualizar MVs em osteoblastos intactos para entender a biogênese do tráfego MV. Para a linha de células de osteoblastos, eles usaram a linha de células de osteoblastos de murino (camundongo) KUSA-A1, com alta capacidade osteogênica in vitro e in vivo. Após a cultura de células em condições adequadas, Iwayama et al. observaram as células com SE-ADM para identificar estruturas intracelulares normais. Os cientistas observaram MVs para se alinhar com as fibrilas de colágeno após 4 a 10 dias de crescimento celular em meio osteogênico e o tamanho da partícula secretada aumentou devido à fusão ou crescimento de partícula, com seus tamanhos consistentes com relatórios anteriores para sugerir que eram de fato MVs.
Após exame adicional com SE-ADM, eles notaram o envolvimento da via lisossomal para transportar e secretar MVs intraluminais em um processo semelhante aos exossomos. Interessantemente, ambos os exossomos e MVs são categorizados como vesículas extracelulares com tamanhos semelhantes; ambos são secretados pelos osteoblastos e têm funções compartilhadas durante a comunicação célula-célula.

Caracterização de vesículas contendo minerais. (A e B) Imagens de partículas de alta resolução antes (A) e após (B) a remoção de células cultivadas em meio osteogênico por 7 dias. Mapas de pseudocolor de imagens de partículas ampliadas indicadas por setas vermelhas são mostrados no lado direito de (B). As partículas apresentam estruturas muito suaves sem cristais. (C) Imagens de microscopia eletrônica de varredura (SEM) e análise espectrométrica EDX de partículas em um filme de SiN. A imagem SEM no lado esquerdo exibe o filme de SiN após a remoção das células cultivadas em meio normal, que não mostra partículas, e os dados espectrométricos de EDX não mostram picos de fósforo e cálcio. Em contraste, a imagem SEM e os dados espectrométricos EDX do lado direito mostram partículas e picos agudos de fósforo e cálcio após cultura em meio osteogênico. (D) Análise de elementos de partículas usando mapas espectrométricos EDX. As partículas continham fósforo, cálcio, carbono, e nitrogênio. (E) Espectros Raman obtidos de osteoblastos cultivados com ou sem meio osteogênico por 23 dias. O pico agudo de 960 cm − 1 foi evidente apenas em meio osteogênico (lado direito). a.u., unidades arbitrárias. (F) Comparação de imagens SE-ADM de osteoblastos nocaute de Alpl (KO) em meios normais e osteogênicos. As partículas desapareceram completamente em meios osteogênicos. (G) Espectro de EDX de partículas de osteoblastos Alpl KO em um filme de SiN. Os dados espectrométricos EDX do lado esquerdo exibem o filme de SiN após a remoção das células cultivadas em meio normal, que não mostram picos de fósforo e cálcio. Além disso, as partículas nos meios osteogênicos dos dados do lado direito não mostram picos no fósforo e no cálcio. Barras de escala, 1 μm em (A), (C, principal), (D), e (F); 200 nm em (B); 100 nm em (B, direito). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
Na próxima etapa, Iwayama et al. examinou se essas partículas eram MVs contendo cálcio e / ou fosfato. Por esta, eles cultivaram as células em meio osteogênico por 7 dias e as observaram usando SE-ADM para registrar estruturas muito lisas sem facetas de cristal. Isso sugeriu que as MVs não cristalizaram, mas permaneceram amorfas, como também registrado em um estudo anterior. Quando os cientistas examinaram os MVs em um filme de SiN (mononitreto de silício), eles observaram picos agudos correspondentes ao fósforo, cálcio, elementos de carbono e oxigênio. Eles confirmaram os resultados usando espectroscopia Raman para mostrar a presença de fosfato de cálcio dentro de MVs.
Os cientistas também investigaram os efeitos da hipofosfatasia, uma condição médica codificada pela Gene Alpl (fosfatase alcalina) , em que os osteoblastos não sofrem mineralização in vitro. Por esta, eles editaram o genoma de células de osteoblastos usando a tecnologia de edição de genoma CRISPR-Cas9 para gerar clones de osteoblastos nocaute de Alpl. Quando Iwayama et al. examinou os clones nocaute usando SE-ADM de alta resolução, eles não observaram MVs, o que foi posteriormente confirmado por análise espectrométrica devido à ausência de picos de fósforo e cálcio.
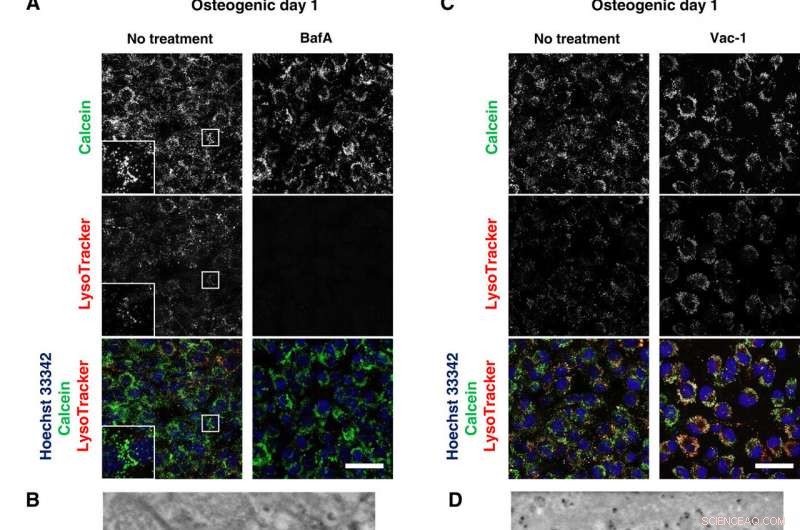
Os inibidores lisossomais bloqueiam a mineralização. (A e C) Imagem ao vivo confocal de osteoblastos tratados com 50 nM BafA ou 10 μM Vac-1. As células foram cultivadas em meio osteogênico contendo BafA ou Vac-1 e coradas com Hoechst 33342 e LysoTracker Insets mostram maior ampliação e área em caixa de cada canal. (B e D) Imagens SD-ADM de osteoblastos tratados com BafA ou Vac-1. As células foram cultivadas em meio osteogênico contendo BafA ou Vac-1. (E) Coloração Alizain Red S realizada sem fixação. As células foram cultivadas em meio osteogênico contendo BafA ou Vac-1 e coradas com Alizain Red S. Imagens confocais representativas. Barras de escala, 50 μm em (A), (C), e (E); 2 μm (B) e (D). Crédito:Science Advances, doi:10.1126 / sciadv.aax0672
Depois de observar diretamente a produção e secreção de MVs usando SE-ADM, os cientistas investigaram ainda o envolvimento de lisossomos no tráfego intracelular de MVs para observar a mineralização de osteoblastos vivos. Eles cultivaram as células em meio osteogênico contendo cálcio e as coraram com LysoTracker para detectar os componentes intracelulares de interesse. Iwayama et al. localizou as vesículas preenchidas com calceína combinadas com lisossomos para sugerir a biogênese de MVs dentro dos lisossomos após sua fusão com a calceína + vesículas. Os cientistas seguiram os experimentos com estudos de perda de função e inibição funcional para desconstruir ainda mais as vias e examinar os mecanismos intracelulares de ação durante a mineralização de células vivas in vitro.
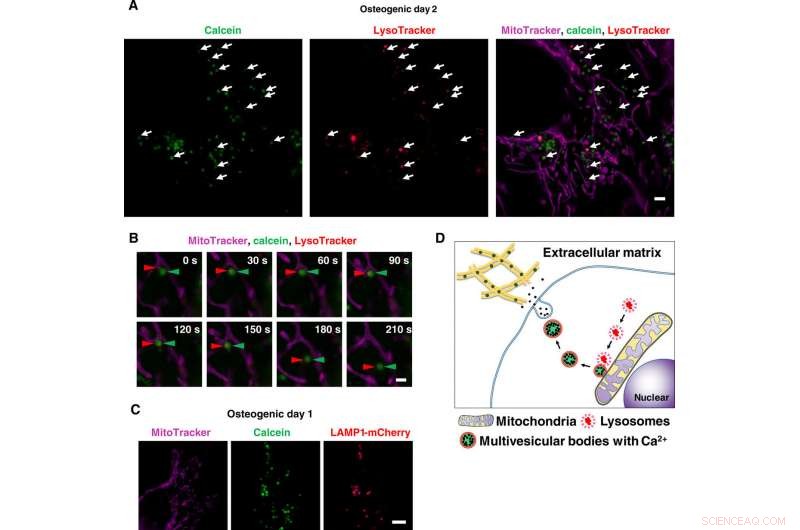
Imagem ao vivo de super-resolução de transportes de vesículas contendo cálcio via lisossomas. (A) Instantâneo de imagens SRM de lapso de tempo de osteoblastos marcados com calceína. As células foram cultivadas com calceína e coradas com Lysotracker e MitoTracker. Setas brancas indicam co-localização de lisossomos e vesículas positivas para calceína. (B) Close-up de imagens SRM de lapso de tempo de osteoblastos marcados com calceína. As pontas de seta vermelhas indicam lisossoma, e pontas de seta verdes indicam calceína. Once lysosomes fused to calcein-positive vesicles adjacent to mitochondria, they started to move toward extracellular space. (C) Representative SRM image of LAMP1-mCherry–expressing cells. Cells were transfected with LAMP1-mCherry plasmid, cultured with calcein, and stained with MitoTracker. Calcein-positive vesicles matched to LAMP1-mCherry–positive lysosomes. (D) Schematic view of lysosomal involvement in transportation of calcium in mineralizing osteoblasts. Scale bars, 2 μm in (A), 1 μm in (B), and 10 μm in (C). Crédito:Science Advances, doi:10.1126/sciadv.aax0672
Scientists had previously reported the involvement of mitochondria during mineralization due to the presence of electron-dense calcium and phosphorous-rich granules in osteoblast mitochondria. This was observed with a modified cryotechnique. Além disso, reports also suggest the direct contact of lysosomes and mitochondria with functional significance. When Iwayama et al. stained cells with LysoTracker together with MitoTracker and observed the intracellular components under N-SIM structured illumination super-resolution microscopy (SRM). They observed the presence of most calcein-fulfilled vesicles next to mitochondria and matched with lysosomes. During SRM-time lapse imaging, the scientists further obtained views of intracellular transport of LysoTracker containing vesicles fused to static calcein vacuoles adjacent to mitochondria to validate their hypothesis.
Desta maneira, together with observations of other SRM systems and additional cell lines, Tomoaki Iwayama and colleagues proposed a mineralization mechanism. Wherein lysosomes played a central role in intracellular MV biogenesis and trafficking within osteoblasts. It was reasonable to involve lysosomes for osteoblasts to transport amorphous calcium phosphate without crystallization during its transport in the cytosol. The scientists aim to conduct further experiments to understand the regulatory molecules for MVs and investigate if MVs and exosomes have similar constitutions and mechanism underlying their generation, secretion and function. The SE-ADM strategy used in the present work can be installed into existing scanning electron microscopy apparatus at a low cost. The work developed in the study will offer non-invasive, high-resolution imaging at the nanoscale applicable to all scientific fields.
© 2019 Science X Network