Se mudar sua polaridade, isso causa um eco no marcador magnético, a partir do qual a distância pode ser calculada. Crédito:© AG Schiemann / Uni Bonn
Cientistas da Universidade de Bonn desenvolveram um método com o qual uma enzima em ação pode ser "fotografada". Seu método permite compreender melhor a função de biomoléculas importantes. Os pesquisadores também esperam obter informações sobre as causas de certos distúrbios enzimáticos. O estudo será publicado na revista Química - Um Jornal Europeu .
Se um alienígena viu a foto de uma tesoura pela primeira vez em um catálogo de suprimentos de artesanato, ele provavelmente não teria ideia para que nós, terráqueos, usamos essa coisa. Se, por outro lado, ele deveria ver um vídeo no qual a tesoura abre e fecha, ele talvez pudesse deduzir sua função com um pouco de imaginação.
Os cientistas têm uma abordagem muito semelhante quando querem entender como uma enzima funciona:se eles conhecem a estrutura da molécula, então, geralmente apenas como uma imagem estática. Eles não sabem como a enzima se comporta em ação, quais partes se movem em direção uma à outra e quais partes se afastam uma da outra.
As enzimas catalisam certas reações químicas nas células, comparável a uma tesoura que corta papel. Eles têm centros catalíticos (as lâminas) que entram em contato com a matéria-prima (o papel). "A forma tridimensional da enzima geralmente muda durante este processo, "explica o Prof. Dr. Olav Schiemann do Instituto de Química Física e Teórica da Universidade de Bonn." Normalmente, essas mudanças conformacionais não podem ser tornadas visíveis, ou apenas com grande esforço. Isso muitas vezes torna difícil compreender o mecanismo de catálise. "
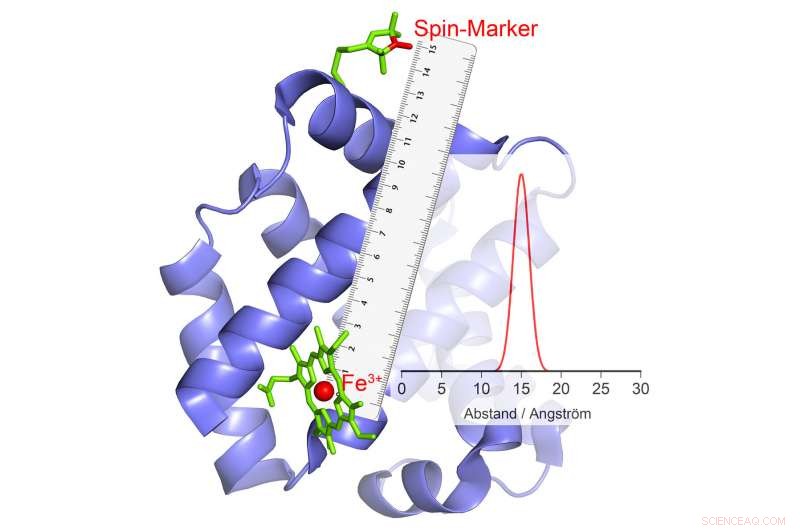
O grupo de pesquisa de Schiemann conseguiu desenvolver um método com o qual os movimentos de partes da proteína umas contra as outras podem ser medidos durante a catálise. Os cientistas de Bonn vêm trabalhando nesses métodos com grande sucesso há vários anos. Em seu estudo atual, eles examinaram um grupo particularmente importante de enzimas. Estes carregam íons metálicos com vários elétrons desemparelhados em seus centros catalíticos. Um exemplo é a hemoglobina, que se liga ao oxigênio com a ajuda de um íon de ferro e, portanto, pode ser transportado no sangue.
Lançando íons
"Nossos métodos atuais são inadequados para esses íons de alta rotação, "explica o colega de Schiemann, Dr. Dinar Abdullin." Portanto, desenvolvemos um novo método, elaborou a teoria e a testou com sucesso. "Os pesquisadores aproveitaram o fato de que os íons de alta rotação se comportam como pequenos eletroímãs. Além disso, eles podem mudar aleatoriamente sua polaridade - eles "invertem":o Pólo Norte se torna o Pólo Sul e o Pólo Sul se torna o Pólo Norte.
Este fenômeno pode ser usado para medição de distância. Aqui, os cientistas associam a enzima a certos compostos químicos que também têm propriedades eletromagnéticas. "Quando os íons de alta rotação invertem, esses pequenos eletroímãs reagem ao campo magnético alterado em seu ambiente, alterando também sua polaridade, "explica Abdullin. Quando e como eles fazem isso depende, entre outras coisas, na distância para o íon de alta rotação. Isso torna possível determinar a distância entre os dois com tanta precisão.
Se vários grupos magnéticos estão ligados a uma enzima, a distância de cada um desses grupos ao íon de alta rotação e, portanto, ao centro catalítico é obtida. "Ao combinar esses valores, podemos medir a posição espacial deste centro, como se estivéssemos usando um GPS molecular, "explica Schiemann." Por exemplo, podemos determinar como sua posição muda em relação aos outros grupos magnéticos no curso da catálise. "
Contudo, os cientistas ainda não são capazes de realmente observar a ação da enzima. “Ainda estamos trabalhando com células congeladas, "diz Schiemann." Estes contêm numerosas enzimas que foram congeladas em diferentes pontos do tempo durante a reação catalítica. Portanto, não obtemos um filme, mas uma série de "fotos - como se a tesoura do exemplo introdutório fosse fotografada em incontáveis momentos diferentes durante o processo de edição.
“Mas já estamos trabalhando na próxima melhoria, "enfatiza o químico:" A medição espacial de biomoléculas em células e em temperatura ambiente ". Os pesquisadores esperam obter insights sobre o desenvolvimento de certas doenças que são desencadeadas por distúrbios funcionais de enzimas.