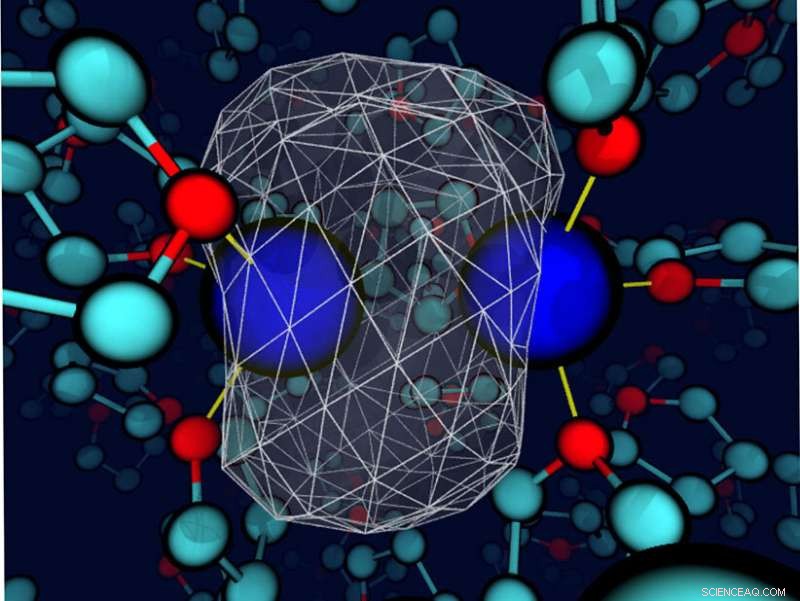
Um “instantâneo” revela que o solvente tetrahidrofurano circundante deforma a densidade de elétrons de ligação em torno de um soluto de sódio. Os núcleos de sódio são esferas azuis; a densidade dos elétrons de valência é representada como uma superfície branca transparente com uma malha de arame branco envolvendo a maior parte da densidade de carga. As ligações entre o sódio e os locais de oxigênio do solvente nas proximidades são finas linhas amarelas. Crédito:Devon Widmer, Universidade da Califórnia, Los Angeles
Jogue algumas amêndoas inteiras em uma jarra cheia de avelãs. Sacudir. As nozes batem umas nas outras, mas eles não reagem. É assim que algumas pessoas pensam sobre as reações que acontecem dentro dos líquidos. Os solutos (amêndoas) reagem entre si em um mar de solventes (avelãs). Mas um novo estudo mostra que nem sempre é o caso para reações químicas reais. Sob as condições certas, o solvente pode alterar a identidade química do soluto.
Muitas reações químicas, particularmente aqueles relevantes para manter pessoas e plantas vivas, acontecer em solução. Esta pesquisa mostra que em muitas dessas reações, o solvente não é um mero espectador. Isso significa reformular expectativas e modelos computacionais. Porque as mesmas regras podem ser aplicadas em laboratórios de química, os pesquisadores podem precisar selecionar seus solventes com mais cuidado. Os solventes podem estar controlando ou alterando a identidade química do soluto.
Embora os solventes sejam cuidadosamente selecionados em alguns casos, os líquidos são frequentemente considerados simplesmente um meio para permitir que os reagentes se encontrem. Contudo, o solvente pode desempenhar um papel maior. Aqui, pesquisadores descobriram que quando o solvente e o soluto interagem (energeticamente na mesma ordem que uma ligação de hidrogênio), o solvente pode controlar a dinâmica da ligação e a identidade química de solutos simples. Os pesquisadores chegaram a esta conclusão estudando um dímero de sódio no solvente fracamente polar tetrahidrofurano. As interações de ligação entre o solvente e os átomos de sódio levaram a estados de coordenação únicos. Esses estados tiveram que cruzar uma barreira de energia livre, essencialmente passando por uma reação química, para interconverter. Avançar, cada estado de coordenação tinha sua própria dinâmica e assinaturas espectroscópicas. Embora os químicos estejam cientes da influência dos solventes em certos casos, esta pesquisa destaca o valor de selecionar cuidadosamente o solvente para criar um ambiente específico em certos sistemas químicos de fase condensada.