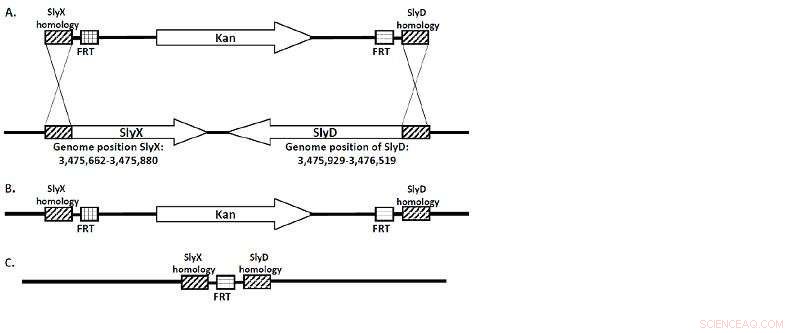
(A) O cassete KanR flanqueado por regiões homólogas SlyX e SlyD. (B) A sequência inteira desses genes é substituída pelo cassete KanR durante a recombinação. (C) A "cicatriz FRT" é tudo o que resta uma vez que a cepa é "curada" pela flp-recombinase. Crédito:Universidade Lobachevsky
Os sistemas bacterianos são algumas das plataformas mais simples e eficazes para a expressão de proteínas recombinantes. Eles são mais econômicos em comparação com outros métodos, e são, portanto, de grande interesse não apenas para pesquisadores da Universidade Lobachevsky, mas também para fabricantes de medicamentos importantes do ponto de vista terapêutico.
Contudo, além das proteínas recombinantes alvo, as células também produzem um grande número de proteínas endógenas, incluindo SlyD. É uma pequena proteína composta por três domínios. Sua região C-terminal é rica em resíduos de histidina, e SlyD exibe portanto uma elevada afinidade para os iões 2-valentes e é purificado juntamente com as proteínas alvo no decurso da cromatografia de afinidade com metais. Isso resulta na necessidade de etapas de purificação adicionais, e como conseqüência, aumenta o custo do processo tecnológico de obtenção de proteínas recombinantes terapêuticas.
Uma equipe de pesquisadores da Universidade Lobachevsky sob o professor Viktor Novikov, Diretor do Centro UNN de Biologia Molecular e Biomedicina, obteve uma série de cepas de E. coli deficientes nos genes SlyD / SlyX. As cepas foram projetadas usando deleção cromossômica mediada por λ-red. (Figura 1.)
"A sequência de SlyD / SlyX no genoma de E. coli foi substituída por um gene responsável pela resistência ao antibiótico canamicina que foi flanqueado em ambos os lados por sítios FRT, de onde foi posteriormente removido pela FLP recombinase, "Notas de Viktor Novikov.
Usando o exemplo da proteína biespecífica recombinante MYSTI-2 consistindo em dois módulos que são centros ativos de anticorpos contra as proteínas F4 / 80 e TNF de camundongo, os cientistas compararam a atividade de proteínas isoladas das cepas original e mutante. Como resultado do estudo, foi determinado que a remoção do genoma de E. coli dos genes SlyD e SlyX, que presumivelmente codificam chaperones que suportam a estrutura espacial das proteínas de Escherichia coli, não resulta na interrupção da atividade funcional das proteínas recombinantes.
Ao obter cepas originais de E. coli, os pesquisadores conseguiram resolver o problema da contaminação de proteínas recombinantes e garantir o sucesso da purificação de um único estágio por cromatografia de afinidade com metais.
"O conjunto obtido de cepas deficientes em slyD / slyX de E. coli pode ser usado para produzir em uma forma pura uma ampla gama de proteínas procarióticas e eucarióticas, incluindo proteínas terapêuticas médicas. Isso facilita o desenvolvimento e a produção de novas preparações biológicas medicinais e preventivas, mais simples e barato, "conclui Viktor Novikov.