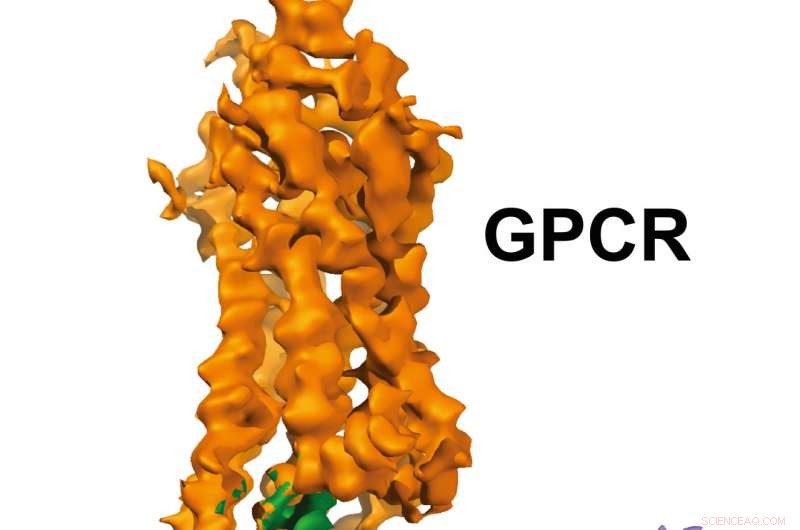
Estrutura GPCR-Gi. Crédito:Laboratório Xu, Van Andel Research Institute
Pela primeira vez, cientistas visualizaram a interação entre dois componentes críticos da vasta rede de comunicação celular do corpo, uma descoberta que poderia levar a medicamentos mais eficazes com menos efeitos colaterais para condições que variam de enxaqueca a câncer.
As imagens de resolução quase atômica, publicado hoje em Natureza , mostram um receptor acoplado à proteína G (GPCR) chamado rodopsina ligado a uma proteína G inibitória, e fornece um plano para um design mais preciso, medicamentos seletivos ao mesmo tempo em que resolve um problema antigo no campo.
"Visualizar este complexo resolve um capítulo que faltava na história do GPCR, finalmente revelando como essas duas moléculas interagem em detalhes requintados, "disse H. Eric Xu, Ph.D., professor do Van Andel Research Institute (VARI) e um dos autores seniores do estudo. "Tudo na biologia é baseado em interações moleculares, então quanto mais sabemos sobre como as estruturas dessas duas moléculas funcionam juntas, a melhor posição em que estaremos para projetar medicamentos melhores com menos efeitos indesejáveis. "
As descobertas de hoje foram possíveis através do uso de uma técnica revolucionária chamada microscopia crioeletrônica (crio-EM), que permite aos cientistas ver moléculas difíceis de visualizar com uma clareza surpreendente.
"O uso de tecnologia crio-EM para obter informações estruturais sobre alvos farmacêuticos importantes, como GPCRs em vários estados, demonstra que agora estamos em posição de aplicar esses métodos para aplicações de descoberta de drogas, "disse Sriram Subramaniam, Ph.D., um investigador do Instituto Nacional do Câncer dos Institutos Nacionais de Saúde e um autor sênior do estudo.
Embutido na membrana celular, GPCRs agem como conduítes entre uma célula e seu ambiente, interagir com proteínas G e outras moléculas de sinalização chamadas arrestinas para transmitir mensagens importantes de e para a célula que regulam uma gama de funções fisiológicas, incluindo crescimento, respostas imunológicas e percepção sensorial.
Quando vinculado a GPCRs, as proteínas G inibitórias regulam a produção de mensageiros químicos secundários que têm efeitos por todo o corpo, de interações com receptores de serotonina no cérebro e no intestino, que ajudam a regular o humor e o apetite, às interações com receptores de dopamina no cérebro, que controlam as respostas de recompensa e o movimento voluntário, entre muitos outros.
Essas interações de amplo alcance com proteínas G e arrestinas, juntamente com sua acessibilidade na parte externa da célula, tornam os GPCRs alvos atraentes para o desenvolvimento terapêutico. Atualmente, mais de 30 por cento dos medicamentos no mercado funcionam interagindo com GPCRs.
"As informações reveladas por nossas descobertas ajudarão a facilitar o desenho de uma nova geração de medicamentos, "disse Yanyong Kang, Ph.D., um cientista pesquisador no Laboratório Xu e co-autor do estudo. "Porque este é o primeiro complexo de proteína G inibitória de GPCR a ser determinado estruturalmente, acreditamos que nossos métodos ajudarão a levar à caracterização de outros importantes, mas GPCRs difíceis de visualizar. "
As imagens 3-D geradas pela equipe revelam uma hélice especializada no final da proteína G inibitória que atua como uma assinatura estrutural, que ajuda GPCRs como a rodopsina a diferenciar entre proteínas G inibitórias e outro tipo de proteína G conhecida como proteína G estimuladora.
As descobertas de hoje são as mais recentes de uma série de novidades para Xu e sua equipe, que incluem um marco de 2015 Natureza estudo que descreveu pela primeira vez a estrutura da rodopsina e arrestina no complexo em conjunto. Este trabalho, que foi saudado como um grande avanço no campo, ganhou a Xu o Prêmio Hans Neurath da The Protein Society e da Hans Neurath Foundation em 2016.
Em um estudo de acompanhamento publicado em Célula em 2017, Xu e seus colaboradores refinaram ainda mais sua estrutura anterior do complexo rodopsina-arrestina, e revelou um conjunto de códigos de fosforilação que ditam a montagem de complexos GPCR-arrestina.
Os GPCRs são notoriamente difíceis de visualizar usando métodos tradicionais de cristalografia de raios-X; Até a presente data, apenas 40 de mais de 800 GPCRs no total tiveram suas estruturas determinadas, incluindo o complexo rodopsina-arrestina de Xu.
Para determinar a estrutura de hoje, a equipe aproveitou o microscópio crioeletrônico Titan Krios de alta potência da VARI, que é capaz de gerar imagens de moléculas 1/10, 000º da largura de um cabelo humano e pode visualizar mais facilmente moléculas como GPCRs que estão embutidas na membrana celular. Krios do Instituto, que faz parte da suíte David Van Andel Advanced Cryo-Electron Microscopy, é um dos menos de 120 microscópios desse tipo no mundo.
Subramaniam e sua equipe foram os pioneiros no uso de crio-EM para determinar algumas das estruturas de maior resolução relatadas até agora usando crio-EM, incluindo vários complexos ligando-proteína clinicamente relevantes.