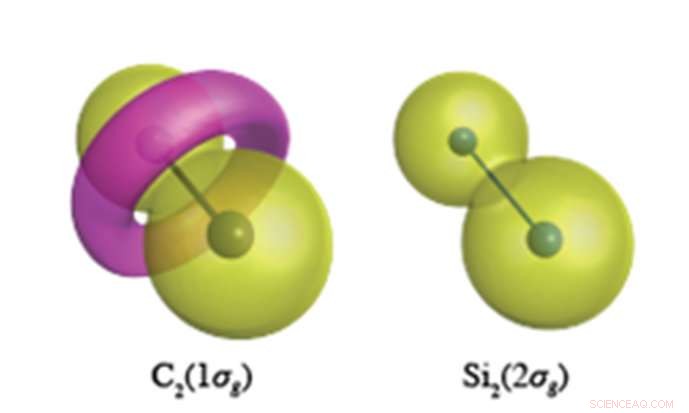
Espera-se que os elétrons do núcleo interno tenham uma função de onda semelhante ao amendoim, como mostrado para o Si 2 elétrons s (direita). Na ligação C-C, Contudo, os elétrons C1s formam um recurso semelhante a um toro de polaridade oposta, mostrado em rosa na figura à esquerda. Crédito:Universidade Nacional de Yokohama
Os pesquisadores do YNU resolveram o antigo mistério de por que o silício não pode substituir o carbono em compostos orgânicos. Um novo cálculo de química quântica de referência de C 2 , Si 2 , e seus hidretos revelam uma diferença qualitativa nas topologias dos orbitais de elétrons centrais de moléculas orgânicas e seus análogos de silício. Os pesquisadores propõem outros elementos com a propensão do carbono para remodelar suas estruturas nodais de elétrons centrais mediante ligação química.
Desde a descoberta do silício e o sucesso de Wöhler em meados do século 19 com a síntese de compostos orgânicos, O próprio Wöhler foi um dos primeiros a sugerir a substituição do carbono pelo silício em compostos orgânicos. Ficou claro no início do século 20 que o silício não tem uma química semelhante ao carbono, e sonhos de vida baseada em silício só sobrevivem na ficção científica. Sabemos empiricamente que o carbono tem a capacidade de formar uma variedade de compostos insaturados, que o silício não. Contudo, a causa raiz de por que apenas o carbono tem essa capacidade permanece um mistério.
Cálculos químicos quânticos de precisão sem precedentes realizados em YNU revelam que os elétrons centrais (que não deveriam participar de ligações químicas) têm um papel muito diferente nos compostos insaturados de carbono e silício. O carbono tem a propensão de alterar a topologia (estrutura nodal) de seus elétrons centrais, que, para C 2 , resulta na formação de um anel tipo toro no orbital 1σg formado por elétrons C1s (ver Figura). Si 2 , Contudo, mantém os orbitais de núcleo esféricos centrados em cada sítio atômico em todas as suas moléculas. Esta flexibilidade dos orbitais centrais do carbono permite que o carbono forme uma cornucópia de diferentes estruturas de ligação de valência, enquanto o silício está restrito a estruturas de ligação ortogonais aos orbitais nucleares esféricos, como os atômicos.
O impacto desta descoberta é de longo alcance. Os elétrons centrais até agora foram considerados mais ou menos inertes, mas talvez seja necessário reavaliar sua contribuição para ligações químicas - pelo menos no caso de ligações insaturadas. Finalmente, o estudo sugere que outros elementos, como nitrogênio, fósforo, e flúor, exibem flexibilidade semelhante para modificar suas topologias de elétrons centrais, e assim, exibem químicas igualmente ricas.
O papel, "Core Electron Topologies in Chemical Compounds:Case Study of Carbon versus Silicon, "é publicado em Angewandte Chemie International Edition vol 57 (24) em 6 de junho, 2018.