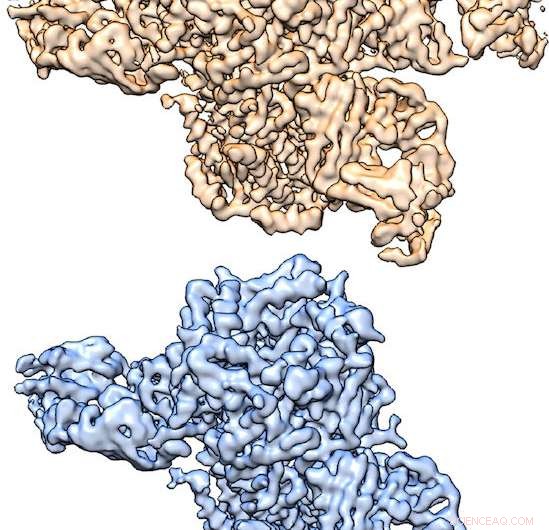
Estruturas tridimensionais do receptor nicotínico de acetilcolina determinadas por crio-EM, cortesia do Hibbs Lab. Crédito:Hibbs Lab, UT Southwestern Medical Center
Pesquisadores da UT Southwestern publicado hoje em Natureza projetos em escala atômica da classe mais abundante de receptores nicotínicos de acetilcolina no cérebro. Uma compreensão estrutural da proteína, encontrados em neurônios, pode levar a novas maneiras de tratar a dependência da nicotina causada pelo fumo e pela vaporização.
Estruturas tridimensionais do receptor nicotínico de acetilcolina determinadas por crio-EM, cortesia do Hibbs Lab. "Quando este receptor se liga ao neurotransmissor acetilcolina ou à nicotina, leva à ativação do neurônio, que então envia sinais para outros neurônios, "disse o Dr. Ryan Hibbs, autor correspondente do estudo e professor assistente de neurociência e biofísica do Peter O'Donnell Jr. Brain Institute da UT Southwestern. "Esse processo de 'neurotransmissão química' é a base de toda comunicação rápida entre os neurônios. Esse receptor específico está intimamente ligado ao vício da nicotina."
Os pesquisadores obtiveram as estruturas de alta resolução usando as instalações de microscopia crioeletrônica (crio-EM) de US $ 22,5 milhões da Universidade, onde as amostras são congeladas rapidamente para evitar a formação de cristais de gelo prejudiciais e, em seguida, visualizadas a 321 graus Fahrenheit negativos (temperaturas criogênicas). A instalação da UT Southwestern - que funciona 24 horas por dia - é uma das principais instalações do mundo para biologia estrutural crio-EM.
Dois novos aspectos do estudo o destacam nos campos da biologia estrutural e da neurociência. Primeiro, os pesquisadores descobriram uma nova biologia sobre como o receptor se liga à nicotina no cérebro, Dr. Hibbs disse. Em segundo lugar, estão as descobertas relacionadas aos aspectos técnicos de como a proteína é montada.
"A descoberta que fizemos sobre as diferentes maneiras pelas quais a nicotina interage com esse receptor pode ajudar no desenvolvimento de drogas para tratar a dependência da nicotina e a neurodegeneração, "acrescentou." Com relação à montagem do receptor, As técnicas clássicas de determinação de estrutura geralmente requerem uma amostra homogênea. Contudo, para esta proteína, o receptor se reúne de várias maneiras que têm consequências biológicas importantes. Por exemplo, um desequilíbrio na proporção dos dois arranjos de subunidades está ligado ao vício da nicotina e à epilepsia congênita. "
A proteína que estudaram é composta por cinco subunidades, de dois tipos - α e β. Essas subunidades α e β se agrupam em duas proporções diferentes em dois complexos distintos de cinco subunidades, uma forma 3α:2β e uma forma 2α:3β. Complexos de ambas as proporções são encontrados no cérebro.
"Usamos uma abordagem de marcação de anticorpos para identificar subunidades e superar desafios na computação crio-EM para obter estruturas de ambos os complexos de cinco subunidades de uma única amostra. Isso não tinha sido feito antes e fornece uma abordagem geral para determinar as estruturas de muitos outros tipos de canais e receptores multissubunidades que têm várias maneiras de se montar, "explicou o Dr. Hibbs, uma Effie Marie Cain Scholar em Pesquisa Médica.
"As duas estruturas são compostas por diferentes proporções de subunidades α e β. Ao usar um anticorpo que se liga apenas às subunidades β, fomos capazes de separar as duas estruturas de uma amostra - um receptor tem dois anticorpos ligados, enquanto o outro tem três limites, "explicou o autor principal Richard Walsh Jr., um estudante de graduação no programa de Biofísica Molecular.
"Ser o autor principal de um manuscrito aceito é em si uma experiência extremamente gratificante; ser o autor principal de um estudo aceito por Natureza ainda parece surreal, " ele adicionou.
O laboratório Hibbs foi anteriormente capaz de obter a estrutura de um dos dois complexos usando cristalografia de raios-X, a primeira na época devido à dificuldade de cristalizar as proteínas da membrana.
"Para proteínas de membrana em particular, obter cristais que difratarão em alta resolução é um desafio, o que torna o cryo-EM particularmente poderoso. Fomos previamente capazes de obter um desses arranjos de subunidades do receptor nicotínico por cristalografia de raios-X. Cryo-EM nos deu os dois arranjos, de uma única amostra, em resolução mais alta, "Dr. Hibbs disse.