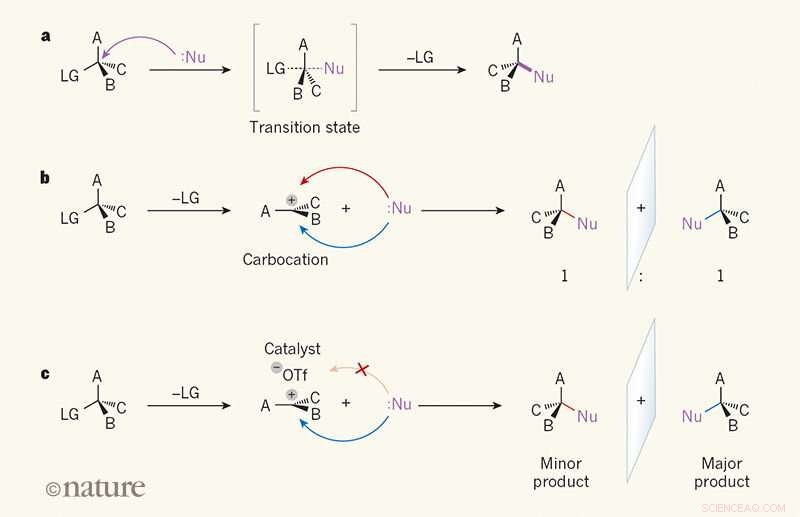
Seletividade de imagem em espelho em reações de substituição. uma, Em uma reação SN2, um reagente denominado nucleófilo (Nu; os pontos indicam um par de elétrons solitário) ataca um átomo de carbono em uma molécula orgânica do lado oposto a um grupo de "saída" (LG). UMA, B e C podem ser qualquer átomo ou grupo. No estado de transição, a ligação entre o átomo de carbono e o LG está parcialmente quebrada, e uma ligação entre Nu e o átomo de carbono é parcialmente formada (ligações parcialmente quebradas e parcialmente formadas são mostradas como linhas tracejadas). O vínculo com a LG então se rompe, e um único produto é formado. b, Na reação SN1, o LG é lançado primeiro, e um plano, o intermediário carregado denominado carbocátion se forma. Como o Nu pode atacar o carbocátion com a mesma facilidade de ambos os lados, o produto se forma como uma proporção de 1:1 de isômeros de imagem de espelho (enantiômeros). c, Wendlandt et al.1 relatam uma reação SN1 em que um catalisador de molécula pequena e um íon triflato (-OTf) se ligam a um lado do carbocátion, direcionando o nucleófilo para o outro lado. Um enantiômero é, portanto, produzido preferencialmente. Crédito: Natureza (2018). DOI:10.1038 / s41586-018-0042-1
Uma equipe de pesquisadores da Universidade de Harvard, nos EUA, desenvolveu uma maneira de nos fazer uma reação SN1 para fazer estereocentros de carbono quaternário. Em seu artigo publicado na revista Natureza , a equipe descreve a superação da tendência das reações SN1 de destruir a estereoquímica para fazer o material centrado no carbono. Tobias Morack e Ryan Gilmour, da Universidade de Münster, na Alemanha, ofereça um artigo News &Views sobre o estudo na mesma edição do jornal.
Como observam os pesquisadores, até agora, não houve um bom método para fazer estereocentros quaternários. Métodos atuais, eles notam, tendem a ser baseados em substratos pró-quirais, que são eles próprios um desafio a fazer. Neste novo esforço, a equipe de Harvard propôs uma nova abordagem - baseada na reação SN1.
As reações SN1 são a base dos cursos introdutórios de química orgânica, mas eles notoriamente causam estragos com a estereoquímica. Apesar disso, os pesquisadores acreditaram que poderiam usar o intermediário carbocátion plano produzido em tais reações como substrato. Para esse fim, eles surgiram com uma reação SN1 que converteu uma mistura de acetato de propargila (com quantidades iguais de enantiômeros destros e esquerdos - um racêmico) em uma mistura com um centro quaternário. Um doador de ligação de hidrogênio foi usado como um catalisador para remover os materiais acetoxi que foram substituídos por uma mistura de alila - o resultado foi um único enantiômero.
Os produtos finais eram interessantes, Morack e Gilmour observam, porque os estereocentros de carbono tinham uma ampla gama de orbitais de elétrons. Isso significa que eles têm geometrias físicas diferentes e, portanto, reagem de maneira diferente. Isso abre a porta para usá-los para produzir uma ampla variedade de moléculas que podem ser usadas em várias reações para a síntese de novos produtos químicos.
Os pesquisadores observam que o trabalho não terminou - eles planejam tentar a mesma abordagem com compostos que não são tão estáveis. Fazendo isso, eles reconhecem, exigirá o uso de um catalisador que é ainda mais reativo. Eles também planejam conduzir a reação com diferentes nucleófilos.
© 2018 Phys.org