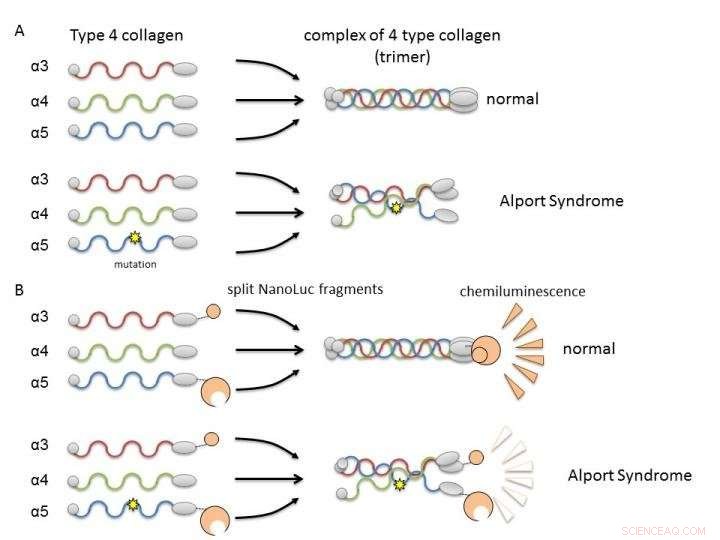
(A) Colágeno IV alfa-3, alfa-4, e alfa-5 normalmente formam complexos (trímeros) e tornam-se constituintes da membrana basal do rim. Na Síndrome de Alport, a mutação genética em uma das cadeias interrompe a formação do trímero. (B) Ao fundir cadeias de colágeno a fragmentos de Nanoluciferase, é possível avaliar a formação de trímero de alfa-3, alfa-4, e alfa-5 pela intensidade de luminescência. Crédito:Dr. Kohei Omachi
A síndrome de Alport (AS) é uma doença renal hereditária causada por uma mutação genética que leva a anormalidades do colágeno tipo IV (Col4). Infelizmente, o tratamento através da correção da funcionalidade Col4 ainda não foi desenvolvido. Agora, pesquisadores da Universidade Kumamoto no Japão estabeleceram uma tecnologia altamente sensível para avaliar a funcionalidade do Col4, pavimentando o caminho para drogas terapêuticas. Este sistema de detecção reduz os custos de trabalho e tempo em comparação aos métodos convencionais, e monitora a funcionalidade do Col4 com maior sensibilidade do que nunca. O sistema também permite analisar vários compostos candidatos a fármacos simultaneamente.
Os inibidores da ECA e outros medicamentos para o tratamento da hipertensão retardam a progressão da EA. Contudo, este tratamento apenas alivia os sintomas e não pode prevenir a transição para a insuficiência renal em estágio terminal. Portanto, considera-se que o tratamento fundamental deve se concentrar na causa do aparecimento da doença, uma abordagem que é completamente diferente dos métodos anteriores. A estratégia terapêutica, nesse caso, se concentraria na normalização da função da proteína causadora com um composto de droga candidato. Se for bem sucedido, esta técnica contribuiria muito para o tratamento de outras doenças hereditárias.
Para normalizar a função da proteína causadora com um composto de droga candidato, é necessário rastrear e identificar com eficiência compostos que restaurem a função comprometida pela mutação genética. Contudo, um sistema de análise para avaliar a funcionalidade das proteínas causadoras ainda não foi desenvolvido. Esse sistema pode ser usado para rastrear candidatos a drogas terapêuticas. Assim, Os pesquisadores da Universidade Kumamoto pretendiam estabelecer um novo sistema de avaliação (um sistema de triagem composto) apenas para esse propósito.
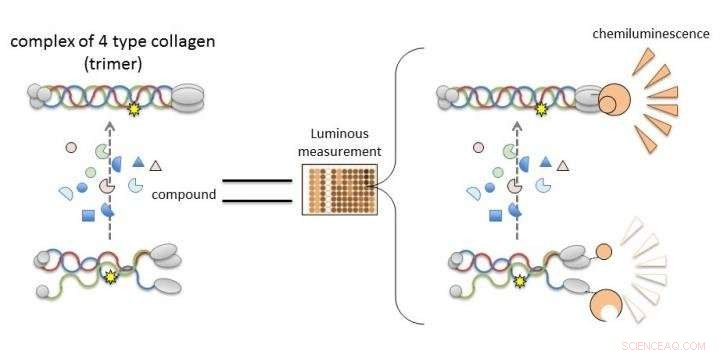
Colágeno IV alfa-3, alfa-4, e alfa-5 na Síndrome de Alport não pode formar trímeros, de modo que a descoberta de compostos que levam a ou melhoram sua formação levará ao desenvolvimento de novas terapias. Novo trabalho da Universidade de Kumamoto possibilita avaliar a trimerização das cadeias alfa do colágeno IV por meio da medição da luminescência. Os compostos que induzem luminescência no sistema NanoLuc-Col4 provavelmente promovem a trimerização. Crédito:Dr. Kohei Omachi
Em Col4, três cadeias polipeptídicas (proteínas semelhantes a bastonetes), alfa-3, alfa-4, e alfa-5, formam um complexo denominado trímero de proteína. Este trímero é um fator constituinte da membrana basal na parte do rim chamada glomérulo. A membrana basal glomerular é uma barreira física contra o vazamento de componentes do sangue durante a filtração do sangue, uma importante função renal para a produção de urina. Uma mutação em qualquer uma das três cadeias polipeptídicas pode interromper a formação de trímeros e resultar no desenvolvimento de AS devido a uma falha em formar adequadamente a membrana basal. Portanto, é necessário pesquisar compostos que possam corrigir ou auxiliar a formação de trímeros pelo colágeno mutante.
Os pesquisadores usaram split NanoLuciferase (split NanoLuc, NanoBiT) tecnologia para análise de interação proteína-proteína como um método de avaliação da formação de trímeros. Fragmentos de duas moléculas grandes e pequenas de luciferase foram fundidos com cadeias alfa-3 e alfa-5 e expressos em células com cadeias alfa-4. A luminescência mensurável foi detectada apenas quando alfa-3, alfa-4, e as cadeias alfa-5 podem formar trímeros.
Os pesquisadores esclareceram que o sistema NanoLuc-Col4 reflete características relatadas anteriormente de Col4, ou seja, que os trímeros são formados com uma combinação fixa de alfa-3, alfa-4, e cadeias alfa-5, e que as cadeias alfa-5 não podem formar trímeros se estiverem faltando uma parte funcional. O sistema NanoLuc-Col4 também revelou que as cadeias alfa-5 com as mutações genéticas relatadas em AS não funcionaram. Mais importante, como prova do princípio de que corrigir a formação de trímeros para colágeno mutante é viável, os autores foram capazes de usar o sistema para identificar compostos que foram capazes de induzir a formação de trímero de alfa-3, alfa-4 e colágeno alfa-5 mutante.
"Esta pesquisa deve fornecer um caminho para o desenvolvimento de medicamentos para doenças hereditárias, como a Síndrome de Alport, que atualmente são incuráveis, "disse o professor Hirofumi Kai, do Departamento de Medicina Molecular da Universidade de Kumamoto.
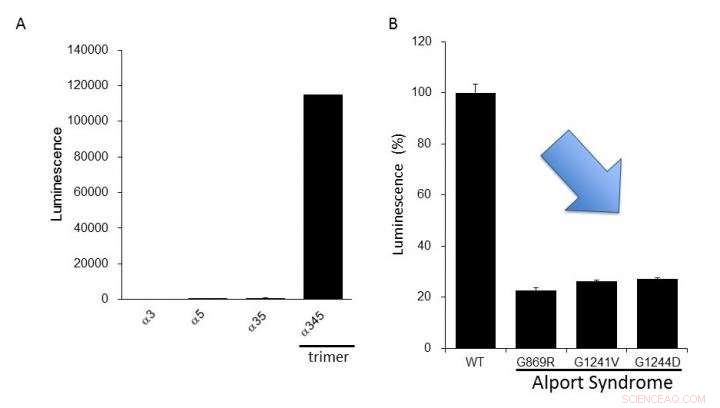
(A) Expressão de colágeno IV alfa-3, alfa-4, e alfa-5 em células. Alta luminescência foi produzida apenas na formação do trímero alfa-345. (B) As proteínas alfa-5 mutantes relatadas na Síndrome de Alport tiveram uma formação de trímero menor do que a do tipo normal (WT). Isso sugere que podemos avaliar as anormalidades funcionais do colágeno IV encontradas na Síndrome de Alport usando este sistema de ensaio. Crédito:Dr. Kohei Omachi