Uma equipe de pesquisa da Universidade de Kyushu realizou uma síntese eletroquímica contínua de um composto alcoólico a partir de um ácido carboxílico usando uma célula de eletrossíntese de álcool eletrolítico de polímero, que permite a carga de energia direta no composto alcoólico. Crédito:Masaaki Sadakiyo / International Institute for Carbon Neutral Energy Research, Universidade Kyushu
O interesse em energia renovável continua crescendo. Muitas energias renováveis, no entanto, pode ser frustrantemente intermitente. Quando o sol fica obscurecido pelas nuvens, ou o vento para de soprar, o poder flutua. O fornecimento flutuante pode ser parcialmente suavizado pelo armazenamento de energia durante os horários de pico de produção. Contudo, armazenar eletricidade tem seus desafios.
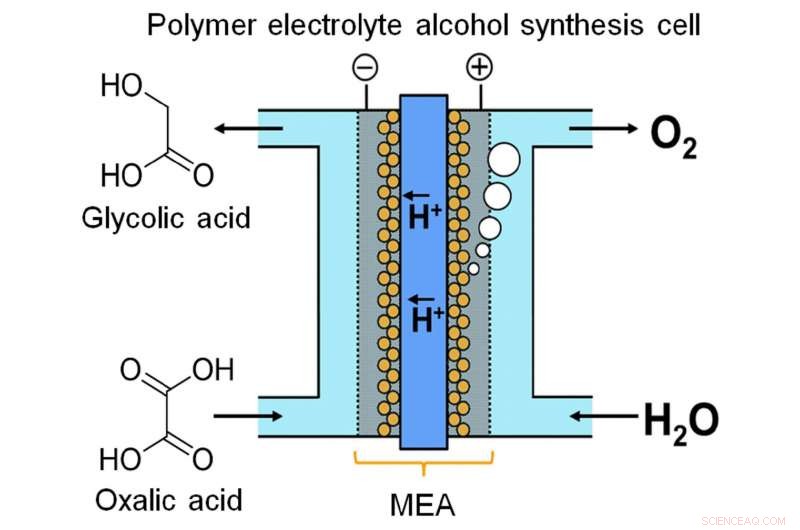
Recentemente, uma equipe da Universidade de Kyushu criou um dispositivo para armazenar energia na forma química por meio de eletrólise contínua. Os pesquisadores notaram que o ácido glicólico (GC) tem uma capacidade de energia muito maior do que o hidrogênio, um dos produtos químicos de armazenamento de energia mais populares. GC pode ser produzido por redução de quatro elétrons de ácido oxálico (OX), um ácido carboxílico amplamente disponível. Conforme descrito em sua publicação em Relatórios Científicos , a equipe desenvolveu uma célula eletrolítica baseada em um novo conjunto membrana-eletrodo. Imprensado entre dois eletrodos estão um ânodo à base de óxido de irídio e um cátodo de titânio (Ti) revestido com dióxido de titânio (TiO2), ligados por uma membrana de polímero.
"Os sistemas de fluxo são muito importantes para o armazenamento de energia com reação em fase líquida, "diz o autor principal Masaaki Sadakiyo." A maioria dos eletrolisadores que produzem álcoois opera um processo em lote, que não é adequado para este propósito. Em nosso dispositivo, usando um eletrólito de polímero sólido em contato direto com os eletrodos, podemos executar a reação como um fluxo contínuo sem adição de impurezas (por exemplo, eletrólitos). A solução OX pode ser considerada efetivamente como um pool de elétrons fluente. "
Outra consideração importante é o design do cátodo. A reação catódica é catalisada por anatase TiO2. Para garantir uma conexão sólida entre o catalisador e o cátodo, a equipe "cresceu" TiO2 diretamente no Ti na forma de uma malha ou feltro. Imagens do microscópio eletrônico mostram o TiO2 como uma penugem fina, agarrando-se à parte externa das hastes de Ti como uma camada de neve fresca. Na verdade, seu trabalho é catalisar a eletro-redução de OX a GC. Enquanto isso, no ânodo, a água é oxidada em oxigênio.
A equipe descobriu que a reação se acelerou em temperaturas mais altas. Contudo, aumentar muito a temperatura incentivou um processo secundário indesejado - a conversão de água em hidrogênio. O equilíbrio ideal entre esses dois efeitos foi a 60 ° C. Nesta temperatura, o dispositivo pode ser ainda mais otimizado diminuindo o fluxo de reagentes, enquanto aumenta a quantidade de área de superfície disponível para a reação.
Interessantemente, até mesmo a textura do catalisador TiO2 difuso fez uma grande diferença. Quando o TiO2 foi preparado como um "feltro, "crescendo em hastes de Ti mais finas e densamente compactadas, a reação ocorreu mais rápido do que na malha - provavelmente por causa da maior área de superfície. O feltro também desencorajou a produção de hidrogênio, cobrindo a superfície de Ti de forma mais confortável do que a malha, evitando a exposição do Ti nu.
"Nas condições certas, nossa célula converte quase 100 por cento do OX, que consideramos muito encorajador, "diz o co-autor Miho Yamauchi." Calculamos que a capacidade volumétrica máxima de energia da solução de GC é cerca de 50 vezes a do gás hidrogênio. Para ser claro, a eficiência energética, em oposição à capacidade, ainda está atrás de outras tecnologias. Contudo, este é um primeiro passo promissor para um novo método para armazenar o excesso de corrente. "