Crédito:CEA
Após 40 anos de pesquisa, pesquisadores do CEA, CNRS, Universidade Grenoble-Alpes, A Universidade de Montpellier e a Inserm finalmente identificaram a enzima responsável pela destirosinação da tubulina. Surpreendentemente, não é uma enzima, mas duas que controlam a modificação desse componente essencial da estrutura do citoesqueleto. Este trabalho abre novas perspectivas para uma melhor compreensão do papel desempenhado pela tubulina, desregulamentação que tem sido associada a cânceres, doenças cardiovasculares e distúrbios neurais.
Um projeto colaborativo internacional envolvendo pesquisadores da CEA (Comissão Francesa de Energia Atômica), CNRS (Centro Nacional Francês de Pesquisa Científica), Inserm (Instituto Nacional Francês de Saúde e Pesquisa Médica), Universidade Grenoble-Alpes, A Universidade de Montpellier e a Universidade de Stanford identificaram a enzima, Tubulina Carboxipeptidase (TCP), responsável pela transformação bioquímica dos microtúbulos celulares, através da destirosinação. A detirosinação é uma reação biológica que resulta na remoção do aminoácido tirosina terminal da α-tubulina, uma das subunidades que constituem os microtúbulos. Após quatro décadas de pesquisa, biólogos finalmente conseguiram purificar esta proteína, e forneceram evidências de sua atividade celular.
Os microtúbulos contribuem para as funções celulares essenciais
Microtúbulos são fibras dinâmicas presentes em todas as células, são formados pela combinação de duas proteínas (α-tubulina e β-tubulina). Os microtúbulos desempenham inúmeras funções:eles separam os cromossomos para distribuí-los entre as duas células filhas durante a divisão celular; eles contribuem para a polaridade celular, morfologia e migração celular; eles também formam uma rede dentro da célula, em que constituintes celulares, como proteínas ou fitas de RNA, pode ser transportado.
Essas funções celulares são reguladas por "sinais" que estão presentes na superfície dos microtúbulos. Esses sinais, consistindo em modificações bioquímicas de aminoácidos (conhecidas como modificações pós-tradução, como ocorrem após a síntese de proteínas), ocorrem em vários locais nas células e são executados por uma ampla gama de enzimas; nesse caso, as enzimas modificam as tubulinas.
A enzima TCP, finalmente identificado após 40 anos de mistério
A atividade de uma dessas enzimas foi identificada pela primeira vez em 1977 por uma equipe de pesquisa argentina. Eles chamaram essa atividade de "TCP" (Tubulina Carboxipeptidase). Esta enzima demonstrou realizar a reação de detirosinação:remoção do aminoácido terminal, uma tirosina, do final da α-tubulina, mas a proteína em si ainda precisava ser identificada (seu tamanho e sequência eram desconhecidos). Outra enzima, a ligase TTL, realiza a reação reversa - tirosinização - por meio da qual a tirosina é substituída. O ciclo de destirosinação / tirosinação é vital para a célula e o organismo como um todo. A detirosinação maciça (anormal) é observada em vários tipos de câncer graves e em doenças cardiovasculares.
A identificação e caracterização do TCP foi, portanto, um objetivo principal para os pesquisadores que desejavam compreender a função fisiológica da detirosinação da α-tubulina e determinar as consequências de sua inibição.
Para isolar TCP, os pesquisadores monitoraram sua atividade, usaram técnicas bioquímicas convencionais, e colaborou com químicos da Universidade de Stanford, que desenvolveu uma pequena molécula inibindo sua atividade. Essa molécula foi então usada como isca para "prender" a evasiva enzima.
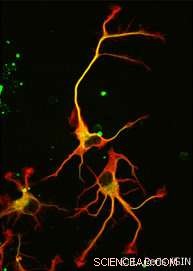
No fim, nenhum, mas duas enzimas foram descobertas. VASH1 e VASH2 já eram conhecidos pelos cientistas, mas eles não tinham sido previamente associados ao citoesqueleto. Os pesquisadores demonstraram que, quando associado a uma proteína parceira chamada SVBP, VASH1 e VASH2 podem causar destirosinação da α-tubulina. Para demonstrar esta atividade, a equipe inibiu a expressão de VASH1 / 2 (ou de seu parceiro SVBP) nos neurônios. Em ambos os casos, um declínio muito forte no nível de destirosinação de α-tubulina foi observado juntamente com morfologia neuronal alterada (ver Figura). Os pesquisadores passaram a demonstrar que essas enzimas também estão envolvidas no desenvolvimento do córtex cerebral.
Assim, 40 anos após a primeira evidência de detirosinação de α-tubulina ter sido apresentada, as enzimas responsáveis foram identificadas. Os cientistas agora esperam que, modulando a atividade do TCP e melhorando seu conhecimento do ciclo de detirosinação / tirosinação, eles serão capazes de desenvolver novos tratamentos para cânceres específicos, e obter uma melhor compreensão de suas funções cerebrais e cardíacas.