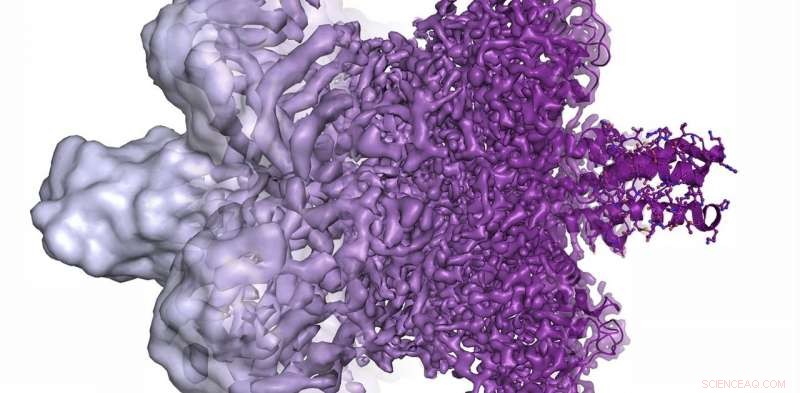
A resolução do microscópio eletrônico melhorou radicalmente nos últimos anos, desde a exibição de bolhas disformes (à esquerda) em 2013 até agora ser capaz de visualizar proteínas em resolução atômica (à direita) no presente. Crédito:Martin Högbom / The Royal Swedish Academy of Sciences
Os cientistas que desenvolveram a capacidade de ver alguns dos blocos de construção da vida sob o microscópio eletrônico foram agraciados com o Prêmio Nobel de Química de 2017.
Jacques Dubochet, Joachim Frank e Richard Henderson foram os pioneiros da microscopia crioeletrônica, que a Real Academia Sueca de Ciências disse que simplifica e melhora a imagem de moléculas biológicas, conhecido como biomoléculas.
O prêmio de 9 milhões de coroas suecas (A $ 1,4 milhão) é dividido igualmente entre Dubochet, na Universidade de Lausanne, na Suíça, Frank, na Columbia University de Nova York, e Henderson, no Laboratório MRC de Biologia Molecular, Cambridge, no Reino Unido.
A Academia disse que o método desenvolvido pelos três pesquisadores mudou a bioquímica para uma nova era. A tecnologia agora permite que os pesquisadores gerem uma visão de alta resolução das biomoléculas enquanto elas existem em seu estado natural.
A fechadura biológica e a chave
O corpo humano é incrivelmente complexo e requer a cooperação de uma série de mecanismos bioquímicos, como digestão e produção de energia, para funcionar bem. Esses processos intrincados envolvem o uso de biomoléculas, entidades tipicamente grandes feitas de aminoácidos - os blocos de construção da vida.
Mais importante, assim como a construção de qualquer casa de tijolo, a configuração ou colocação dos blocos é crítica para o quão bem a nossa construção se levanta, ou quão bem nossas biomoléculas funcionam.
Além disso, biomoléculas apresentam sua capacidade de realizar tarefas interagindo com outras entidades, tais enzimas, no corpo. Eles são baseados em uma configuração específica, muito parecido com o modo como apenas uma chave pode abrir uma fechadura específica.
O grande desafio superado pela equipe premiada foi desenvolver a capacidade de observar as biomoléculas em seu estado natural. Antes do advento da microscopia crioeletrônica, eles foram visualizados com cristalografia de raios-X.
Também se pensava que os microscópios eletrônicos eram adequados apenas para imagens de matéria morta, porque o poderoso feixe de elétrons destrói o material biológico.
O principal avanço veio com o desenvolvimento de um processo para congelar rapidamente uma amostra. Isso permitiu que as biomoléculas fossem capturadas em sua configuração personalizada.
A equipe identificou no início de seu trabalho que o congelamento de uma amostra antes da visualização pode proporcionar a melhoria necessária para interrogar totalmente as biomoléculas.
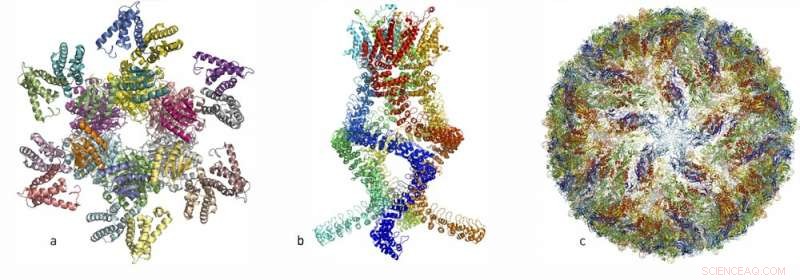
Ao longo dos últimos anos, pesquisadores publicaram estruturas atômicas de vários complexos complexos de proteínas:(à esquerda, a) um complexo de proteínas que governa o ritmo circadiano, (Centro, b) um sensor do tipo que lê as mudanças de pressão no ouvido e nos permite ouvir, e (certo, c) o vírus Zika. Crédito:A Real Academia Sueca de Ciências
Parado no tempo
É aqui que começa a diversão. Embora pareça inerentemente simples, congelar rapidamente uma amostra é particularmente desafiador.
Se o processo remove a água da amostra, a biomolécula entra em colapso, perdendo a configuração natural desejada pelos pesquisadores. Se a amostra for congelada muito lentamente, então se formam cristais de gelo, que também interfere na configuração da biomolécula.
A equipe desenvolveu um processo conhecido como vitrificação. Isso congela a amostra a -190 ℃ enquanto é colocada em uma tela de arame, uma abordagem elegantemente simples para resolver um problema difícil.
Como a maioria das conquistas científicas ganhadoras do Prêmio Nobel, o desenvolvimento foi incremental. As mudanças da equipe ao longo de muitos anos permitiram a combinação do processo de congelamento (desenvolvido em 1978) e a tecnologia de microscopia que só foi totalmente realizada em 2013.
Essa combinação e o avanço da tecnologia possibilitaram a geração de imagens de alta resolução de biomoléculas.
Desbloqueando um vírus
Então, o que tudo isso significa? Nós vamos, compreender a configuração da fechadura permite que os cientistas cortem uma determinada chave.
Os vírus são grandes biomoléculas. Uma vez visualizado, os cientistas podem identificar moléculas ou desenvolver chaves farmacêuticas que podem se encaixar em sua estrutura a fim de separá-las ou interromper sua função.
Um exemplo do poder da microscopia crioeletrônica é visto por meio da rápida caracterização do vírus Zika logo depois de ter sido identificado pela primeira vez como um grande risco à saúde global.
A identificação da configuração do vírus e da bolsa da biomolécula que se junta ao seu hospedeiro formará a base para estudos em andamento sobre a melhor forma de combater esse vírus.
A tecnologia também teve impacto na mesa de jantar. Uma equipe de pesquisa dos EUA investigou o componente sensor de calor da língua, destacando o sensor wasabi. Isso pode oferecer o potencial para entender melhor as novas abordagens de controle da dor.
Na Austrália, um consórcio está explorando o poder dessa tecnologia para investigar doenças relacionadas ao sistema imunológico a fim de desenvolver melhores protocolos de tratamento.
A microscopia crioeletrônica será uma área empolgante de se observar em um futuro próximo, para serralheiros e entusiastas da ciência.
Este artigo foi publicado originalmente em The Conversation. Leia o artigo original. 