
Uma reconstrução 3-D de uma fibrila amilóide a partir de dois protofilamentos (vermelho / azul) calculado a partir de imagens de microscopia crioeletrônica. Crédito:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
Uma equipe de pesquisadores da Alemanha e da Holanda determinou a estrutura de uma fibrila amilóide com resolução anteriormente não alcançada. As fibrilas da proteína beta amilóide (Aβ) do próprio corpo são o principal constituinte dos depósitos de proteínas cerebrais associados à doença de Alzheimer. A estrutura tridimensional de nível atômico elucidada pelos cientistas revela aspectos até então desconhecidos do crescimento de depósitos prejudiciais e do efeito de fatores de risco genéticos. Os resultados foram publicados na renomada revista. Ciência .
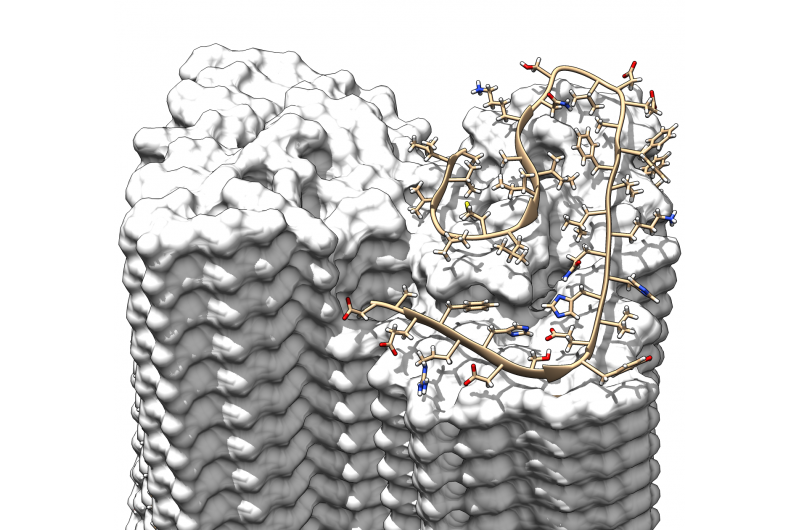
A estrutura revela como as muitas moléculas de proteína Aβ individuais são escalonadas em camadas umas sobre as outras e são organizadas nos chamados protofilamentos. Dois desses protofilamentos são unidos um ao outro para formar uma fibrila. Se várias dessas fibrilas ficarem emaranhadas, eles dão origem aos depósitos ou placas características que são detectadas nos tecidos cerebrais de pacientes com Alzheimer.
"Este é um marco no caminho para uma compreensão fundamental das estruturas amilóides e doenças relacionadas, "diz o Prof Dieter Willbold." A estrutura da fibrila responde a muitas perguntas sobre o mecanismo de crescimento da fibrila e identifica o papel desempenhado por toda uma série de mutações familiares que levam ao início precoce da doença de Alzheimer. "
A resolução de 4 angstroms, correspondendo a 0,4 nanômetros, está dentro da magnitude típica de raios atômicos e comprimentos de ligação atômica. Em contraste com o trabalho anterior, o modelo mostra pela primeira vez a posição exata e as interações das proteínas. As moléculas Aβ dos protofilamentos emaranhados não estão, portanto, no mesmo nível, mas como um zíper, eles são escalonados por meio intervalo. Além disso, a estrutura elucida a localização e conformação de todos os 42 resíduos de aminoácidos das muitas moléculas de proteína Aβ individuais pela primeira vez.
Essa estrutura detalhada fornece uma nova base para a compreensão do efeito estrutural de uma série de modificações genéticas que aumentam o risco de desenvolver a doença. Eles estabilizam as fibrilas alterando o projeto da proteína em locais definidos. Isso também explica porque na natureza os ratos não desenvolvem Alzheimer, e por que uma pequena parte da população islandesa parece ser mais ou menos resistente à doença. Suas variantes de Aβ diferem em três ou um resíduo de aminoácido, respectivamente, que são aparentemente importantes para a estabilidade das fibrilas.
Diversidade metodológica no mais alto nível tecnológico
Em contraste com as placas que são típicas para a doença descoberta por Alois Alzheimer há mais de 100 anos, a estrutura da fibrila agora descoberta não pode ser observada diretamente ao microscópio óptico. Demorou mais de um ano para analisar os dados que os cientistas obtiveram usando as instalações de microscopia crioeletrônica da Universidade de Maastricht. Além disso, medições usando espectroscopia de ressonância magnética nuclear de estado sólido (NMR) e experimentos de difração de raios-X ajudaram a complementar e apoiar totalmente a imagem da estrutura da fibrila e validar os dados obtidos.
"As imagens individuais na microscopia crioeletrônica costumam ser extremamente ruidosas, pois as proteínas são muito sensíveis à radiação eletrônica e as imagens só podem ser geradas com intensidade de radiação muito baixa, "explica Jun.-Prof. Gunnar Schröder. Usando um procedimento assistido por computador, ele combinou milhares de imagens individuais e, assim, extraiu dados estruturais de alta resolução delas.
"Esta é uma etapa que pode ser muito complicada se a amostra consistir em fibrilas formadas de forma diferente. No passado, isso quase sempre acontecia com as fibrilas amiloides e representava um dos maiores obstáculos para a análise. Contudo, agora tínhamos um espécime bastante único com fibrilas muito homogêneas - 90 por cento delas tinham a mesma forma e simetria, "diz Schröder.
O Dr. Lothar Gremer conseguiu produzir a amostra de fibrila. "A etapa crucial foi retardar muito o crescimento das fibrilas na amostra, de algumas horas a várias semanas. Deste modo, as moléculas Aβ individuais tiveram tempo suficiente para se organizar em fibrilas homogêneas de uma forma muito uniforme e altamente ordenada, "diz Gremer, quem iniciou e coordenou o estudo.
Um corte transversal através da fibrila ilustrando o arranjo de sobreposição gradual das proteínas Aβ Crédito:Forschungszentrum Jülich / HHU Düsseldorf / Gunnar Schröder
As investigações do espécime de fibrila por espectroscopia de ressonância magnética nuclear de estado sólido forneceram dados adicionais para construir o modelo e ajudaram a validar a estrutura. "O NMR nos permitiu obter informações adicionais, como quais resíduos de aminoácidos formam pontes de sal, aumentando assim a estabilidade das fibrilas, "explica o Prof. Henrike Heise. Os experimentos de difração de raios-X supervisionados pelo Prof. Jörg Labahn no Centro de Biologia de Sistemas Estruturais em Hamburgo confirmaram adicionalmente os resultados.
A microscopia crioeletrônica é um método de pesquisa relativamente novo para determinar a estrutura das moléculas de proteínas. No passado, os cientistas usaram principalmente a cristalografia de raios-X e a espectroscopia de ressonância magnética nuclear. Em 2015, a microscopia crioeletrônica foi eleita o método de pesquisa do ano pela revista Métodos da Natureza . Com o método consagrado de cristalografia de raios-X, as proteínas primeiro precisam ser convertidas em uma forma cristalina, enquanto que com microscopia crioeletrônica e também espectroscopia NMR, os blocos de construção da proteína podem ser investigados em seu estado natural. No caso da microscopia crioeletrônica, os espécimes são primeiro dissolvidos em água, em seguida, flash congelado, e finalmente investigado com um microscópio eletrônico. Este método tem vantagens particulares quando se trata de investigar grandes estruturas compostas por centenas ou milhares de proteínas.
O estabelecimento de uma instalação para microscopia crioeletrônica de alta resolução poderia dar aos cientistas de Jülich a oportunidade de investigar moléculas biológicas. Além da pesquisa básica, O Instituto de Sistemas Complexos de Jülich (ICS-6) também está desenvolvendo uma nova estratégia de tratamento com seu próprio candidato a medicamento.