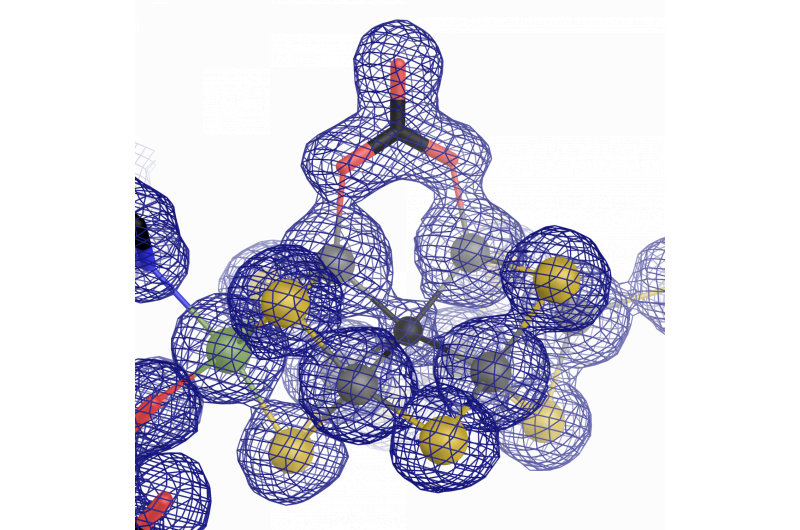
O centro catalítico da nitrogenase de vanádio:um cofator ferro-vanádio com um ligante carbonato incomum. Crédito:Oliver Einsle
A equipe de pesquisa do Prof. Dr. Oliver Einsle, do Instituto de Bioquímica da Universidade de Freiburg, há muito tempo explora o funcionamento da nitrogenase. Agora o grupo está apresentando a primeira análise estrutural tridimensional da variante da enzima que contém vanádio. No âmbito da preparação da sua tese de doutoramento, Daniel Sippel conseguiu produzir e cristalizar nitrogenase de vanádio. Tomando isso como base, ele usou experimentos de difração de raios-X para elucidar sua estrutura espacial no nível de resolução atômica. O objetivo de longo prazo da equipe é tornar a nitrogenase biotecnologicamente útil para desenvolver alternativas aos processos químicos industriais. Os pesquisadores apresentaram suas descobertas na revista científica Nature Chemical Biology .
O elemento nitrogênio (N) é um componente chave de todas as macromoléculas orgânicas. Sua disponibilidade na biosfera é limitada pelo fato de que a ocorrência global de nitrogênio está confinada em grande parte ao gás N2 na atmosfera. Além disso, a estabilidade do N2 o torna inacessível a quase todos os organismos. O nitrogênio biologicamente disponível para fertilizantes agrícolas tem sido feito desde 1906 usando o processo Haber-Bosch. Este processo industrial converte o nitrogênio atmosférico (N2) em amônia por meio de uma reação com o hidrogênio. Seu significado é tão importante hoje porque a produção de alimentos para mais da metade da população mundial só pode ser garantida com a ajuda de fertilizantes de nitrogênio. Na natureza, apenas uma enzima - nitrogenase bacteriana - pode atingir a mesma reação, mas sem emitir excesso de compostos de nitrogênio no meio ambiente, ou em outras palavras, lixiviação de nitratos para as águas subterrâneas. Ainda até agora, a função deste complexo, O sistema enzimático contendo metal que contém metal foi apenas parcialmente explicado.
A equipe de Einsle já deu um passo significativo em direção a uma maior compreensão da nitrogenase. Os pesquisadores foram capazes de inibir a atividade da enzima usando o gás tóxico monóxido de carbono (CO) para mostrar como o inibidor se liga ao cofator ferro molibdênio (FeMoco). Conhecido como o núcleo da nitrogenase, foi nomeado de acordo com os elementos que contém. FeMoco pode catalisar a reação de nitrogênio e hidrogênio em uma versão natural do processo Haber-Bosch. Ao mesmo tempo, sabia-se que uma variante da nitrogenase contendo vanádio em vez de molibdênio em seu centro ativo e, portanto, chamada FeVco, também pode converter o monóxido de carbono. Os produtos dessa reação são compostos de carbono reduzidos na forma de cadeias curtas de carbono. Esta reação é a versão enzimática de um segundo processo químico significativo - a síntese Fischer-Tropsch de hidrocarbonetos que pode ser usada em grande escala para sintetizar combustíveis a partir de gases residuais industriais, por exemplo.
A nitrogenase de vanádio encontrada nas bactérias do solo pode, em seu ambiente natural, realizar a mesma síntese que só é possível em processos industriais com o auxílio de pressões extremas e altas temperaturas. Os processos Haber-Bosch e Fischer-Tropsch são usados anualmente para converter centenas de milhões de toneladas dos respectivos gases - N2 e CO - tornando a possibilidade de um processo sustentável, alternativa biológica de considerável interesse científico.
Durante o trabalho de pesquisa, tornou-se aparente que a maioria das partes da arquitetura da enzima eram semelhantes à "original" contendo molibdênio. No entanto, há uma distinção importante que os diferencia - a estrutura atômica do cofator catalítico. Sippel e Einsle descobriram que um íon vanádio substitui o íon molibdênio em FeVco, e inclui uma substituição adicional de um íon sulfeto de ponte por um ânion carbonato quimicamente muito diferente (μ-1, 3 carbonato - ligante de ponte). O que inicialmente parece ser uma ligeira diferença tem efeitos de longo alcance na estrutura geométrica e eletrônica do cofator.
A pesquisa está sendo financiada pelo Conselho Europeu de Pesquisa (ERC) e pela Fundação Alemã de Pesquisa (DFG) no âmbito do grupo de treinamento em pesquisa 1976 "Diversidade Funcional de Cofatores" da Universidade de Freiburg e do Programa Prioritário "Ferro-Enxofre para Vida."