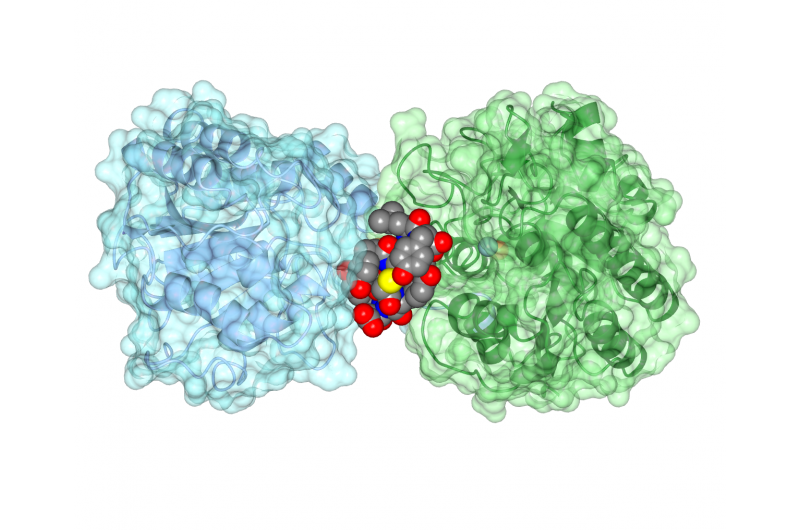
O peptídeo cíclico ipglicermida se liga a uma enzima iPGM, bloqueando sua atividade. Crédito:Jim Inglese, NCATS
Equipes de pesquisa dos Institutos Nacionais de Saúde e de outros países identificaram o primeiro inibidor de uma enzima que há muito se pensava ser um alvo potencial para o combate a bactérias e parasitas causadores de doenças. As equipes, liderado pelos cientistas do Centro Nacional para o Avanço das Ciências Translacionais (NCATS) e da Universidade de Tóquio do NIH, classificou mais de 1 trilhão de pequenos fragmentos de proteína chamados de peptídeos cíclicos para descobrir dois que poderiam desligar a enzima. A descoberta, relatado em 3 de abril, Em 2017 Nature Communications , poderia preparar o terreno para o desenvolvimento potencial de novos tipos de medicamentos antimicrobianos.
Experiência do NCATS na fase inicial, A descoberta de moléculas pré-clínicas ajudou as equipes a encontrar candidatos a medicamentos em potencial que poderiam ter implicações para milhões de pessoas em todo o mundo.
"O trabalho é uma excelente demonstração de como o NCATS cumpre sua missão de fornecer melhorias nos processos de tradução, "disse Anton Simeonov, Ph.D., diretor científico, Divisão de inovação pré-clínica do NCATS. "Os cientistas mostraram que um alvo terapêutico, anteriormente considerado intratável por empresas farmacêuticas, na verdade, pode ser drogado por meio de um agente terapêutico não tradicional. "
A enzima alvo, Fosfoglicerato mutase independente de cofator (iPGM), é encontrado em parasitas e bactérias. Vários tipos de lombrigas parasitas têm iPGM, incluindo Brugia malayi e Onchocerca volvulus, que infecta cerca de 150 milhões de pessoas que vivem principalmente em regiões tropicais. Esses parasitas podem causar doenças infecciosas devastadoras, como a oncocercose. A enzima também é encontrada em bactérias, incluindo Staphylococcus aureus, que pode causar a infecção hospitalar MRSA (Staphylococcus aureus resistente à meticilina), e Bacillus anthracis, que causa antraz.
"Vários organismos infecciosos são potencialmente suscetíveis a um inibidor de iPGM, "disse o co-autor correspondente James Inglese, Ph.D., diretor, Laboratório de Desenvolvimento de Ensaios e Tecnologia de Triagem NCATS. "A equipe apelidou de ipglicermidas dos peptídeos inibidores, 'que representam uma classe poderosa de inibidores de iPGM. Em teoria, tal droga poderia se tornar um tratamento antiparasitário e antibacteriano de amplo espectro ”.
Medicamentos antiparasitários atuais, como ivermectina, trabalham principalmente nos primeiros estágios larvais do verme. Esse tratamento deve ser dado anualmente ou semestralmente por até uma década. Por anos, os cientistas tentaram encontrar um medicamento mais eficaz que também funcionasse contra o verme adulto e os estágios posteriores da infecção. Estudos anteriores feitos por colaboradores de Inglese na New England Biolabs em Ipswich, Massachusetts, mostraram que o iPGM é uma das muitas enzimas essenciais de que a lombriga precisa para sobreviver. É parte de um processo biológico comum chamado glicólise, o que ajuda a produzir energia para as células. Embora o mesmo processo importante ocorra nas células humanas, ele depende de uma forma diferente da enzima. Como resultado, uma droga que tem como alvo o iPGM e mata a lombriga provavelmente deixaria a contraparte humana em paz. Essa droga pode funcionar em todas as fases da vida do verme, e a infecção possivelmente poderia ser tratada de forma aguda, semelhante a um antibiótico. Contudo, suas tentativas anteriores de encontrar um composto para bloquear a enzima falharam.
As enzimas são proteínas que impulsionam as reações químicas. A maioria das enzimas tem "sítios ativos" em forma de bolso nos quais uma molécula se encaixa, e sobre o qual a enzima atua. Medicamentos de pequenas moléculas podem se encaixar em locais ativos e prevenir, ou inibir, a enzima de fazer seu trabalho biológico. Mas o iPGM e outras enzimas semelhantes são diferentes. iPGM tem vida curta, site ativo temporário, tornando praticamente impossível encontrar um medicamento de molécula pequena que possa bloquear a enzima.
Por causa do design incomum da enzima, a equipe liderada pelo NCATS buscou um tipo de medicamento diferente dos medicamentos típicos de pequenas moléculas. Inglês colaborou com o co-autor correspondente Hiroaki Suga, Ph.D., na Universidade de Tóquio, para construir uma mistura de biblioteca de mais de 1 trilhão de pequenos peptídeos. A equipe deu um passo adiante, adicionar um aminoácido aos peptídeos para criar peptídeos cíclicos em forma de anel, que os cientistas supuseram que teria a forma e a estrutura necessárias para se ligar à superfície da enzima e desativar a enzima.
Os pesquisadores vasculharam repetidamente os peptídeos cíclicos para descobrir qual ficaria mais aderido à enzima. Eles descobriram dois peptídeos cíclicos que se ligam fortemente apenas à enzima iPGM e também desligam sua atividade.
A equipe posteriormente trabalhou com biólogos estruturais da Universidade de Kansas, Lawrence, para determinar a estrutura do arranjo de peptídeo cíclico de iPGM, mostrando como o peptídeo impediu a enzima de funcionar corretamente. "O peptídeo cíclico tem afinidade surpreendentemente forte e seletiva para iPGM, como um anticorpo, "Disse Inglese.
Os próximos passos do grupo serão encontrar maneiras de os peptídeos cíclicos entrarem nas células. "Se pudermos encontrar maneiras de colocar peptídeos cíclicos nas células, então isso abriria novos alvos que as drogas de pequenas moléculas têm dificuldade em abordar, "Inglese disse." As ipglicermidas representam uma paisagem fértil, porém não cultivada, entre drogas de moléculas pequenas e proteínas biológicas. "