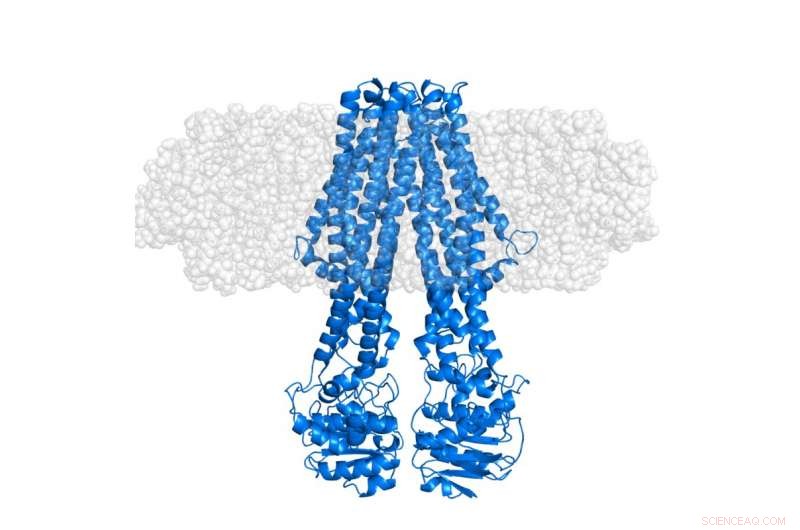
A proteína de membrana integral MsbA (azul) incorporada em um nanodisco membranoso "semitransparente" (cinza). O nanodisco em si é, por meio de deuteração seletiva, tornado invisível em experimentos SANS que se concentram na conformação da proteína em seu contexto nativo. Crédito:Institut Laue-Langevin
As membranas que envolvem nossas células contêm um grande número de proteínas. As proteínas da membrana são, portanto, uma classe crucial de macromoléculas em sistemas vivos. Eles desempenham papéis importantes, como fornecer gateways de transporte para dentro e fora da célula, facilitando a sinalização entre as células, além de estar envolvido na catálise enzimática. Esses papéis funcionais os tornam particularmente importantes como alvos de drogas, com a maioria das terapêuticas atuais direcionadas às proteínas de membrana.
Contudo, estudos estruturais de proteínas integrais de membrana (IMPs) têm se mostrado extremamente desafiadores, uma vez que a maioria deles é difícil de estudar adequadamente na ausência de seu ambiente lipídico. Isso geralmente impede que eles sejam cristalizados - um método comumente usado na biologia estrutural clássica. Abordagens alternativas são, portanto, necessárias para estudos estruturais de PIMs em ambientes membranosos. Para este propósito, o Grupo de Ciências da Vida no Institut Laue-Langevin (ILL), em colaboração com a Universidade de Copenhague, foi pioneira com sucesso no desenvolvimento de nanodiscs portadores furtivos. Nesta abordagem, um método sofisticado de rotulagem de deutério é usado para tornar a membrana efetivamente invisível para difração de nêutrons de baixa resolução, enquanto ainda destaca a estrutura de IMPs dentro de seu ambiente lipídico usual, conforme publicado na Acta Crystallographica D em 2014.
Mais recentemente, o primeiro estudo estrutural de uma proteína de membrana integral usando esta estratégia de deuteração de nanodisco transportadora furtiva acaba de ser concluído. Isso foi realizado usando a plataforma de Deuteration Laboratory (D-Lab) da Partnership for Structural Biology (PSB) em conjunto com espalhamento de nêutrons de baixo ângulo (SANS) e espalhamento de raios-X (SAXS) fornecidos através da plataforma PSB SANS / SAXS . Conforme publicado no jornal Estrutura por Josts et al, a equipe internacional, liderado por Henning Tidow, Universidade de Hamburgo, aplicou este método a uma proteína transportadora de cassete de ligação de ATP (ABC), MsbA - que desempenha um papel importante no transporte de lipídios em bactérias. Os dados de espalhamento de nêutrons resultantes, principalmente adquirido usando o instrumento D11 no ILL, permitiu a observação direta do sinal da proteína de membrana solubilizada sem contribuição do lipídeo circundante. Os dados SAXS forneceram uma referência clara para a forma externa do nanodisco, inclusive da bicamada lipídica.
Além disso, mudanças conformacionais em MsbA foram estudadas, demonstrando a sensibilidade do método e sua aplicabilidade geral para estudos estruturais de MIs.
Esta abordagem tende a se tornar cada vez mais importante em estudos futuros sobre essas dificuldades, mas extremamente importante, macromoléculas biológicas, por sua vez, apoiando uma melhor compreensão para o desenvolvimento de drogas destinadas às proteínas de membrana.