Pesquisadores alcançam o limite de resolução final em microscopia de fluorescência
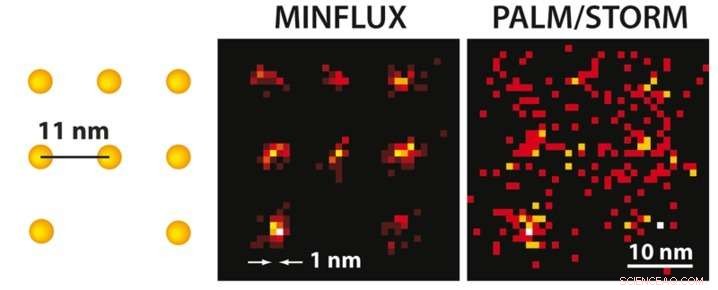 p Com a microscopia MINFLUX, pode-se, pela primeira vez, moléculas separadas opticamente que estão apenas alguns nanômetros de distância umas das outras. À esquerda, um esquema das moléculas fluorescentes é apresentado. Considerando que a microscopia PALM / STORM de ultra-alta resolução com o mesmo brilho molecular (direita) fornece uma imagem difusa das moléculas (aqui em uma simulação em condições técnicas ideais), a posição das moléculas individuais pode ser facilmente discernida com o MINFLUX praticamente realizado (meio). Crédito:MPI f. Química Biofísica / K. Gwosch
p Com a microscopia MINFLUX, pode-se, pela primeira vez, moléculas separadas opticamente que estão apenas alguns nanômetros de distância umas das outras. À esquerda, um esquema das moléculas fluorescentes é apresentado. Considerando que a microscopia PALM / STORM de ultra-alta resolução com o mesmo brilho molecular (direita) fornece uma imagem difusa das moléculas (aqui em uma simulação em condições técnicas ideais), a posição das moléculas individuais pode ser facilmente discernida com o MINFLUX praticamente realizado (meio). Crédito:MPI f. Química Biofísica / K. Gwosch
p É o Santo Graal da microscopia de luz:melhorar o poder de resolução desse método de forma que se possa discernir individualmente as moléculas que estão muito próximas umas das outras. Cientistas do Prêmio Nobel Stefan Hell do Instituto Max Planck de Química Biofísica em Göttingen agora alcançaram o que por muito tempo foi considerado impossível - eles desenvolveram um novo microscópio de fluorescência, chamado MINFLUX, permitindo, pela primeira vez, para separar opticamente as moléculas, que estão apenas nanômetros (um milionésimo de milímetro) de distância um do outro. Este microscópio é mais de 100 vezes mais nítido do que a microscopia de luz convencional e supera até mesmo os melhores métodos de microscopia de luz de super-resolução até hoje, a saber, STED desenvolvido por Hell e PALM / STORM descrito pelo Prêmio Nobel Eric Betzig, em até 20 vezes. Para MINFLUX, Hell usou as vantagens do STED e PALM / STORM em um conceito completamente novo. Esta descoberta abre novas oportunidades para os pesquisadores investigarem como a vida funciona no nível molecular. p "Conseguimos rotineiramente resoluções de nanômetro com MINFLUX, que é o diâmetro das moléculas individuais - o limite final do que é possível em microscopia de fluorescência, "explica o Inferno, Diretor do Instituto Max Planck de Química Biofísica. “Estou convencido de que os microscópios MINFLUX têm potencial para se tornarem uma das ferramentas mais fundamentais da biologia celular. Com esse conceito será possível mapear as células em detalhes moleculares e observar os processos rápidos em seu interior em tempo real. Isso poderia revolucionar nosso conhecimento dos processos moleculares que ocorrem nas células vivas. "
p O físico de Göttingen, que também trabalha no Instituto Max Planck de Pesquisa Médica e no Centro Alemão de Pesquisa do Câncer em Heidelberg, há muito está convencido de que a resolução da microscopia de fluorescência pode ser aumentada até a dimensão de moléculas individuais - com o uso clássico de luz focada e lentes convencionais.
p Na verdade, o físico Ernst Abbe formulou em 1873 que a resolução dos microscópios de luz é limitada a metade do comprimento de onda da luz, que tem cerca de 200 nanômetros. Mais de 100 anos depois, este limite de Abbe ainda é válido. Contudo, O Inferno foi o primeiro a mostrar que esse limite pode ser superado com microscopia STED, que ele concebeu em 1994 e estabeleceu experimentalmente cinco anos depois.
p STED, bem como PALM / STORM, desenvolvido alguns anos depois, na prática, atinge uma nitidez de separação de cerca de 20 a 30 nanômetros - cerca de dez vezes melhor do que o limite de Abbe. Para o desenvolvimento dessas técnicas de microscopia de luz de ultra-alta resolução, Hell e Betzig, juntamente com William E. Moerner, receberam o Prêmio Nobel de Química de 2014.
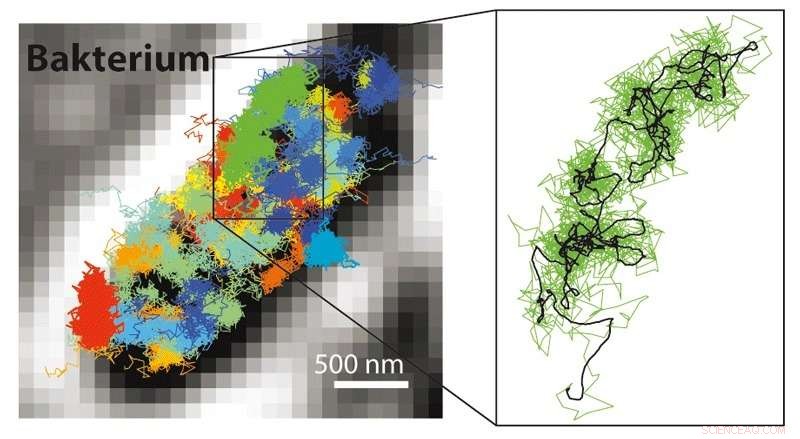 p Com o MINFLUX, é possível acompanhar muitos movimentos muito mais rápidos do que com microscopia STED ou PALM / STORM. Portanto, é possível tornar os movimentos das moléculas marcadas com fluorescência visíveis em uma célula viva. Esquerda:Padrão de movimento de ribossomos 30S (partes de fábricas de proteínas, colorido) em uma bactéria E. coli (preto-branco). À direita:Padrão de movimento de um único ribossomo 30S (verde) ampliado. Crédito:MPI f. Química Biofísica / Y. Eilers
p Com o MINFLUX, é possível acompanhar muitos movimentos muito mais rápidos do que com microscopia STED ou PALM / STORM. Portanto, é possível tornar os movimentos das moléculas marcadas com fluorescência visíveis em uma célula viva. Esquerda:Padrão de movimento de ribossomos 30S (partes de fábricas de proteínas, colorido) em uma bactéria E. coli (preto-branco). À direita:Padrão de movimento de um único ribossomo 30S (verde) ampliado. Crédito:MPI f. Química Biofísica / Y. Eilers
p
Vantagens do STED e PALM / STORM combinados
p Tanto o STED quanto o PALM / STORM separam as moléculas fluorescentes vizinhas, ligando-as e desligando-as uma após a outra, para que emitam fluorescência sequencialmente. Contudo, os métodos diferem em um ponto essencial:a microscopia STED usa um feixe de laser em forma de donut para desligar a fluorescência molecular em um local fixo na amostra, ou seja, em todos os lugares na região focal, exceto no centro do donut. A vantagem é que o feixe de rosca define exatamente em que ponto do espaço a molécula brilhante correspondente está localizada. A desvantagem é que, na prática, o feixe de laser não é forte o suficiente para confinar a emissão a uma única molécula no centro do donut. No caso de PALM / STORM, por outro lado, a ativação e desativação ocorre em locais aleatórios e no nível de uma única molécula. A vantagem aqui é que já se está trabalhando no nível de uma única molécula, mas uma desvantagem é que não sabemos as posições exatas das moléculas no espaço. As posições devem ser descobertas coletando tantos fótons de fluorescência quanto possível em uma câmera; mais de 50, São necessários 000 fótons detectados para atingir uma resolução de menos de 10 nanômetros. Na prática, portanto, não é possível atingir rotineiramente a resolução molecular (um nanômetro).
p O inferno teve a ideia de combinar com exclusividade os pontos fortes de ambos os métodos em um novo conceito. "Essa tarefa era tudo menos trivial. Mas meus colegas de trabalho Francisco Balzarotti, Yvan Eilers, e Klaus Gwosch fizeram um trabalho maravilhoso ao implementar essa ideia experimentalmente comigo. "Sua nova técnica, chamado MINFLUX (FLUXos de emissão mínima), é agora apresentado pelo Inferno junto com os três cientistas juniores como primeiros autores na Ciência.
p MINFLUX, como PALM / STORM, liga e desliga moléculas individuais aleatoriamente. Contudo, ao mesmo tempo, suas posições exatas são determinadas com um feixe de laser em forma de rosca como no STED. Em contraste com STED, o feixe de rosca aqui excita a fluorescência. Se a molécula está no anel, vai brilhar; se estiver exatamente no centro escuro, não brilhará, mas encontrou-se sua posição exata. Balzarotti desenvolveu um algoritmo inteligente para que esta posição pudesse ser localizada muito rapidamente e com alta precisão. "Com este algoritmo foi possível explorar o potencial do feixe de excitação do donut, "explica o jovem cientista. Gwosch, que obteve as imagens resolvidas molecularmente, acrescenta "Foi uma sensação incrível, pela primeira vez, foram capazes de distinguir detalhes com o MINFLUX na escala de alguns nanômetros. "
p
100 vezes melhor resolução
p Além da resolução molecular, a combinação de STED e PALM / STORM oferece uma grande vantagem adicional:"MINFLUX é muito mais rápido em comparação. Como funciona com um feixe de laser donut, requer sinal de luz muito mais baixo, ou seja, menos fótons de fluorescência, por molécula em comparação com PALM / STORM para atingir a resolução final, "Estados do inferno. Já com o STED, era possível gravar vídeos em tempo real do interior de células vivas. Mas agora era possível rastrear o movimento das moléculas em uma célula com uma resolução temporal 100 vezes melhor, como Eilers enfatiza. Ele conseguiu filmar o movimento das moléculas em uma bactéria E. coli viva com MINFLUX pela primeira vez, com uma resolução espaço-temporal sem precedentes. "No que diz respeito à velocidade, não aproveitamos ao máximo as possibilidades com o MINFLUX, "Diz Eilers. Os pesquisadores estão convencidos de que mesmo mudanças extremamente rápidas nas células vivas podem ser investigadas no futuro, como, por exemplo, o movimento de nanomáquinas celulares ou o dobramento de proteínas.

