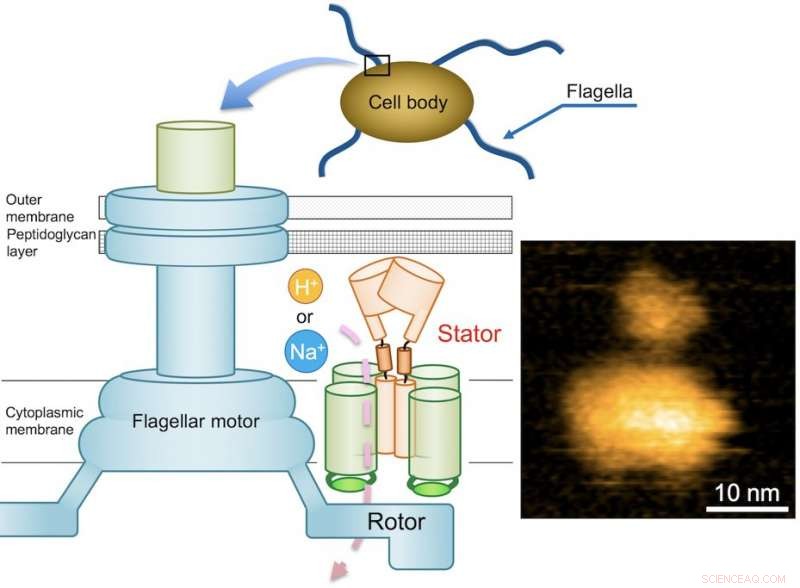
 p Fig. 1. Diagrama esquemático do motor flagelar bacteriano e uma imagem AFM típica do complexo MotPS purificado. Crédito:Universidade de Osaka
p Fig. 1. Diagrama esquemático do motor flagelar bacteriano e uma imagem AFM típica do complexo MotPS purificado. Crédito:Universidade de Osaka
p As bactérias nadam de muitas maneiras diferentes, e os motores que movem sua natação são amplamente variados, implicando uma resposta adaptativa a um ambiente. Um dos motores mais comumente identificados são os flagelos. Embora fornecer motilidade seja uma característica primária dos flagelos, adesivo e outras propriedades também foram atribuídas a eles. p O motor flagelar consiste em um rotor e uma dúzia de unidades de estator, e é impulsionado pela energia criada pelos íons quando eles migram através da membrana celular. Enquanto o motor flagelar de algumas bactérias de água doce e entéricas, como Salmonella, é alimentado por prótons (íons de hidrogênio, H
+
), que consiste em quatro cópias da proteína MotA e duas cópias de MotB, motores de outras bactérias que vivem em ambientes de água salgada são alimentados por íons de sódio (Na
+
)
p No caso de Bacillus subtilis (B. subtilis), uma bactéria comumente encontrada no solo, o motor flagelar tem dois tipos distintos de unidades de estator:tipo H + MotAB e tipo Na + MotPS. Enquanto os componentes são identificados, o mecanismo que alimenta o motor flagelar permanece desconhecido. Este mistério é ainda agravado pelo fato de que os flagelos não são claramente visíveis ao microscópio óptico. Esses desafios colocaram uma equipe de pesquisadores centrados na Universidade de Osaka em uma missão para elucidar o mecanismo desconhecido. Eles relataram suas descobertas em
Avanços da Ciência .
p "Análises precisas da dinâmica estrutural do motor flagelar usando microscopia de força atômica de alta velocidade (HS-AFM) combinadas com análise mutacional forneceram insights sobre o mecanismo de geração de torque do motor flagelar, "disse o primeiro autor do estudo, Naoya Terahara." Fizemos observações em tempo real das mudanças estruturais induzidas por Na + no domínio de MotS que se liga ao peptidoglicano, um polímero que consiste em açúcares e aminoácidos em bactérias. "
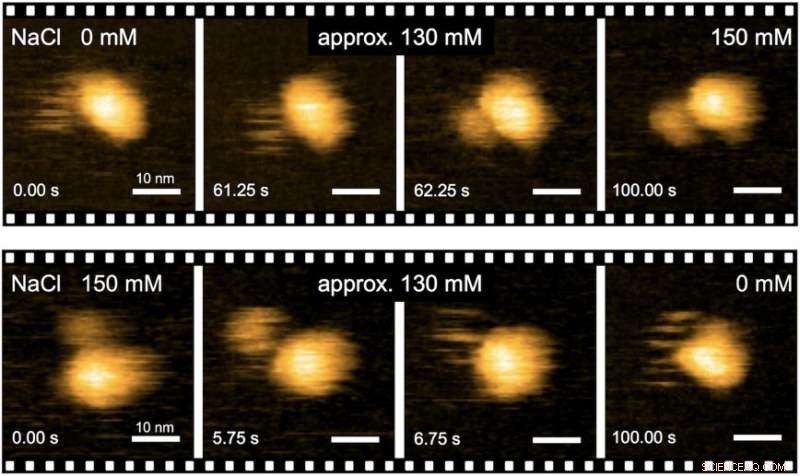 p Fig. 2. Imagem em tempo real de transições estruturais induzidas por Na + do complexo MotPS por HS-AFM. Crédito:Universidade de Osaka
p Fig. 2. Imagem em tempo real de transições estruturais induzidas por Na + do complexo MotPS por HS-AFM. Crédito:Universidade de Osaka
p Para entender como o complexo de proteína MotPS responde às mudanças no ambiente, os pesquisadores primeiro caracterizaram a relação torque-velocidade do motor B. subtilis em uma ampla faixa de concentrações de Na +. A velocidade máxima do motor foi diminuída de cerca de 200 para 80 Hz quando a concentração externa de Na + foi aumentada de 0 para 200 mM, embora o torque de estol não tenha sido alterado.
p Notavelmente, quando o domínio de MotB que se liga ao peptidoglicano foi substituído pelo de MotS, o motor quimérico manteve a mesma curva torque-velocidade do motor MotAB na presença de íons Na +, mas não na ausência. Isso significa que o Na + é o principal motivador da montagem e acionamento do motor flagelar, independentemente de sua composição.
p "Na ausência de íons de sódio, MotPS existe como uma forma inativa na membrana citoplasmática porque MotSc, o domínio periplasmático C-terminal de MotS, adota uma conformação desdobrada. Quando a concentração de íons de sódio é aumentada, a ligação dos íons ao MotSc induz o dobramento do domínio PGB e facilita sua dimerização de uma maneira altamente cooperativa, "o autor correspondente Tohru Minamino diz.
p Por meio deste estudo, a equipe também demonstrou a viabilidade do uso de HS-AFM combinado com análise mutacional para estudar estruturas bacterianas intrincadas, que pode fornecer informações valiosas para a produção industrial de produtos comercialmente viáveis, tais como proteases e terapêuticas, como no caso de B. subtilis.
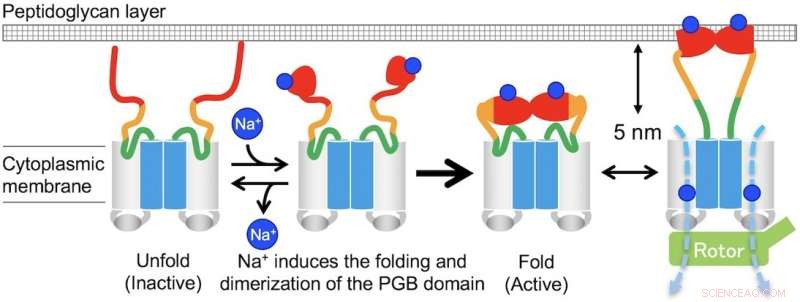 p Fig. 3. Modelo para a montagem induzida por Na + e desmontagem do complexo do estator MotPS. Crédito:Universidade de Osaka
p Fig. 3. Modelo para a montagem induzida por Na + e desmontagem do complexo do estator MotPS. Crédito:Universidade de Osaka


