O fator limitante na radioterapia do câncer é que as doses altas o suficiente para tentar curar os tumores também danificam os tecidos normais circundantes. Crédito:Shutterstock
O câncer é a segunda principal causa de morte no mundo. Em 2018, ocorreram 18,1 milhões de novos casos e 9,5 milhões de mortes relacionadas ao câncer em todo o mundo. Em 2040, espera-se que o número de novos casos de câncer por ano aumente para 29,5 milhões e o número de mortes relacionadas ao câncer para 16,4 milhões.
Aproximadamente 50 por cento de todos os pacientes com câncer podem se beneficiar da radioterapia no tratamento de sua doença. Cerca de metade desses pacientes são diagnosticados precocemente para que o câncer possa ser curado. Para muitos tipos de câncer, incluindo mama, próstata, colo do útero, cabeça e pescoço, câncer de pulmão e cérebro, o tratamento curativo inclui radioterapia. Contudo, porque a radioterapia destrói células saudáveis, bem como células tumorais, as doses são limitadas.
Radioterapia, também chamada de radioterapia, é usado sozinho para tratar o câncer ou com outras opções de tratamento, como quimioterapia e cirurgia. Também pode ser usado para reduzir o tumor antes da cirurgia. Na radioterapia, células tumorais - que se dividem muito mais rápido do que outras células saudáveis circundantes - são destruídas ao danificar seu DNA.
Os efeitos colaterais limitam a dose de radiação
O fator limitante na radioterapia é que as doses altas o suficiente para tentar curar tumores não metastáticos de alto risco (localmente avançado) também danificam os tecidos normais circundantes. Atualmente, estamos no limite da dose de radioterapia que pode ser dada aos pacientes. Para melhorar ainda mais a sobrevivência, há uma necessidade de novos métodos que aumentem a eficácia da radiação enquanto reduzem os efeitos colaterais.
Uma maneira de conseguir isso é tornando as células tumorais mais sensíveis à radiação, portanto, essas células são mais facilmente danificadas pela radioterapia. O uso de nanopartículas de ouro como radiossensibilizadores tem mostrado resultados promissores. Essas nanopartículas de ouro podem ser introduzidas por via intravenosa para se acumular no tumor, explorando as paredes defeituosas dos vasos sanguíneos do tumor, que tendem a vazar devido ao crescimento rápido.
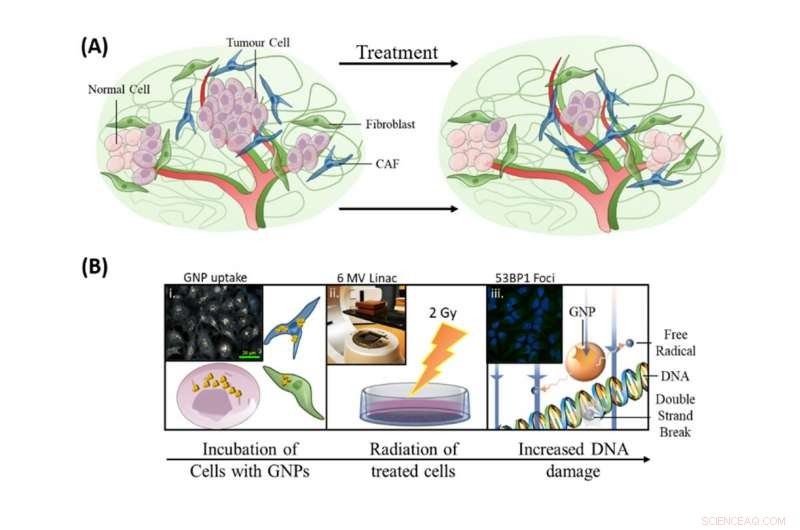
Incorporar nanopartículas de ouro em protocolos de tratamento de radiação atuais tinha três objetivos:aumentar a morte de células tumorais, para direcionar CAFs e para proteger fibroblastos. Crédito:Bromma et al. (2020), Relatórios Sci, 10, 2181., Autor fornecido
Nanopartículas de ouro interagem com fótons de raios-X usados no tratamento de radiação que produz elétrons, que então interagem com as moléculas de água para produzir radicais livres. Esses radicais livres podem danificar as células, diminuindo a sobrevivência dessas células.
Compreender o complexo sistema biológico presente dentro e ao redor do tumor é essencial para otimizar o uso dos GNPs de radiossensibilização, conforme descrito por um consórcio de laboratórios, incluindo nosso próprio laboratório de nanociência e desenvolvimento de tecnologia na Universidade de Victoria.
Direcionando interações dentro do tumor
Nesse trabalho, discutimos a importância de examinar quais componentes celulares dentro do microambiente tumoral absorvem as nanopartículas de ouro e se tornam radiossensibilizados. Estamos particularmente interessados em células chamadas fibroblastos ativados, que estão associados à cicatrização de feridas e têm propriedades antitumourogênicas, o que significa que ajudam a combater o crescimento do tumor.
Contudo, fibroblastos ativados podem ser recrutados pelas células tumorais, e se tornam fibroblastos associados ao câncer (CAFs). Em vez de propriedades antitumorigênicas, CAFs promovem a proliferação e metástase de tumores.
A função dos CAFs apóia a ideia de que os tumores são "feridas que não cicatrizam, "e direcionar os CAFs pode ser benéfico para a melhoria dos resultados do tratamento do câncer.

Acúmulo de nanopartículas de ouro (vermelho) no ambiente do tumor. Crédito:Bromma et al. (2020), Relatórios Sci, 10, 2181., Autor fornecido
Conforme ilustrado na imagem acima, nossa pesquisa sobre a incorporação de nanopartículas de ouro em protocolos de tratamento de radiação atuais teve três objetivos:para aumentar a morte de células tumorais, para direcionar CAFs e para proteger fibroblastos.
Para que a radiossensibilização seja eficaz na melhoria do tratamento de radiação, as células visadas pelo tratamento (aquelas associadas ao crescimento do câncer) precisam ter alta absorção das partículas radiossensibilizantes, enquanto as células benéficas precisam ter uma baixa absorção. Isso faz com que as células-alvo sejam mais facilmente destruídas pela radioterapia em doses que os pacientes podem tolerar.
Esses resultados usando tumores 3D cultivados em laboratório são muito encorajadores. Os CAFs tiveram a maior absorção de nanopartículas de ouro por célula, com quase o triplo das células cancerosas, enquanto os fibroblastos tiveram um número relativamente pequeno. Isso também se traduziu em um maior aumento no dano ao DNA nos CAFs em comparação com os outros tipos de células, reduzindo a atividade dos CAFs e retardando o crescimento do tumor.
Esta diferença no dano ao DNA devido ao direcionamento seletivo de células associadas ao câncer em relação às células normais pode permitir que as nanopartículas de ouro sejam uma ferramenta eficaz na futura radioterapia. ajudando a minimizar os danos ao tecido normal, melhorando a dose de terapia de radiação local para o tumor.
Este estudo mostra que o uso de nanopartículas de ouro como um radiossensibilizador permite que mais danos sejam propagados para os CAFs, um elemento que tem se mostrado bastante influente na progressão do câncer. Acreditamos que este trabalho será um alicerce para um regime de tratamento mais eficaz no futuro próximo. Construir um modelo que possa representar com precisão as diferentes interações que ocorrem dentro do microambiente do tumor é essencial para melhorar os resultados do tratamento para os pacientes.
Este artigo foi republicado de The Conversation sob uma licença Creative Commons. Leia o artigo original. 