 p Os pesquisadores montaram três nanoestruturas de DNA distintas, incluindo uma estrutura em forma de C e duas estruturas em forma de barril, e mostraram, por Microscopia Eletrônica de Transmissão, que estavam protegidos por sua estratégia combinada de revestimento e reticulação. Crédito:Wyss Institute da Harvard University
p Os pesquisadores montaram três nanoestruturas de DNA distintas, incluindo uma estrutura em forma de C e duas estruturas em forma de barril, e mostraram, por Microscopia Eletrônica de Transmissão, que estavam protegidos por sua estratégia combinada de revestimento e reticulação. Crédito:Wyss Institute da Harvard University
p Vencer o câncer e uma infinidade de outras doenças não depende apenas de conseguir os medicamentos certos, mas também de levá-los aos lugares certos do corpo, ao mesmo tempo em que mantém os danos aos tecidos saudáveis ao mínimo. Nanoestruturas de DNA, como origami de DNA de automontagem que se dobram em formas definidas, são veículos promissores para a entrega de medicamentos e diagnósticos, e diferentes estratégias de vacinação. Isso ocorre porque eles podem ser funcionalizados de forma flexível com drogas de moléculas pequenas e proteínas, e antígenos imunogênicos, bem como recursos que facilitam sua entrega a células e tecidos-alvo específicos. Além disso, eles são biocompatíveis e biodegradáveis. p O grande potencial das nanoestruturas de DNA para diversas aplicações biomédicas, Contudo, ainda é prejudicado por sua estabilidade limitada nos tecidos e sangue do corpo. William Shih, Ph.D. e sua equipe agora desenvolveu um fácil, eficaz, e abordagem de reticulação química escalonável que pode fornecer às nanoestruturas de DNA a estabilidade de que precisam como veículos de entrega de medicamentos e diagnósticos. Seu estudo foi publicado no
Jornal da American Chemical Society (
JACS )
p "Para ajudar a cumprir a promessa extraordinária das nanoestruturas de DNA, desenvolvemos uma abordagem química amplamente aplicável para aumentar sua resistência à degradação, "disse William Shih, um membro do corpo docente do Instituto Wyss que está liderando o projeto na Iniciativa de Robótica Molecular do Instituto. "Ao modificar as nanoestruturas de DNA em duas etapas fáceis, podemos aumentar drasticamente sua sobrevivência, que remove um gargalo central na tradução desses nanodispositivos em soluções para uma variedade de problemas médicos. "
p Origami de DNA normalmente são montados a partir de uma longa fita de DNA que se dobra em uma forma 3-D definida na escala de nanômetros com a ajuda de várias fitas curtas conectando diferentes partes da estrutura no espaço. A estrutura do DNA é fortemente carregada negativamente, o que significa que trazer diferentes partes dos fios dobráveis próximos uns dos outros pode ser problemático porque eles se repelem naturalmente, semelhantes às superfícies negativas de dois ímãs. Para superar essas forças repulsivas, pesquisadores geralmente adicionam um excesso de íons carregados positivamente, como íons de magnésio (Mg
2
+
) às suas reações de dobramento que cobrem as cargas negativas do DNA.
p Muitas vezes, Contudo, o Mg adicionado
2
+
íons não são suficientemente mantidos em estruturas de origami de DNA 3-D. Especialmente quando introduzido no corpo, onde Mg normal
2
+
as concentrações são muito mais baixas, Mg
2
+
íons vazam das nanoestruturas e fazem com que elas se desintegrem. Além disso, As nanoestruturas de DNA estão sob constante ataque por enzimas de nuclease de DNA que são produzidas naturalmente no corpo e degradam as moléculas de DNA livres, reduzindo drasticamente sua estabilidade, que comumente é medida como sua meia-vida. Segue-se logicamente que, ao interromper a integridade estrutural das nanoestruturas de DNA, essas forças internas e externas também restringem a liberação de drogas ou a disponibilidade de moléculas repórter de diagnóstico.
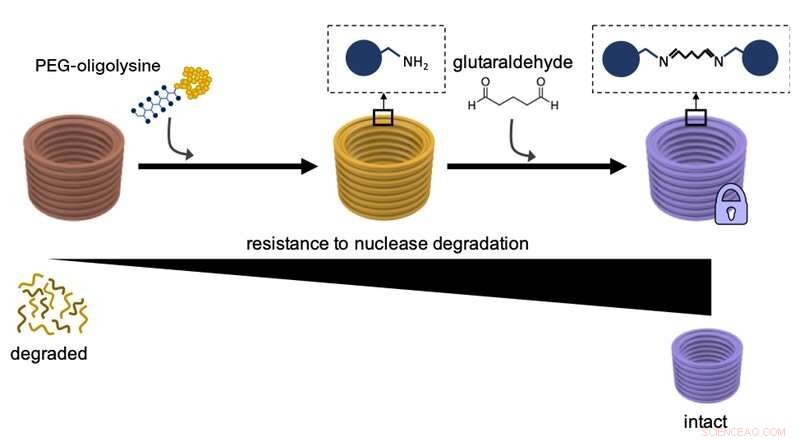 p Este diagrama explica como o primeiro revestimento de nanoestruturas de DNA com PEG-oligolisinas, e a reticulação química de PEG-oligolisinas distintas com glutaraldeído como um agente de reticulação aumenta sua resistência à degradação por enzimas de nuclease de DNA e estabilidade geral. Crédito:Wyss Institute da Harvard University
p Este diagrama explica como o primeiro revestimento de nanoestruturas de DNA com PEG-oligolisinas, e a reticulação química de PEG-oligolisinas distintas com glutaraldeído como um agente de reticulação aumenta sua resistência à degradação por enzimas de nuclease de DNA e estabilidade geral. Crédito:Wyss Institute da Harvard University
p Em um estudo anterior, Shih e sua equipe encontraram uma maneira de superar a necessidade de excesso de mg
2
+
concentrações para estabilizar nanoestruturas de DNA. Ao revestir essencialmente as superfícies das grandes fitas de DNA com um agente neutralizante discreto comparativamente pequeno que carrega múltiplas cargas positivas e é conhecido como PEG-oligolisina (ou oligolisina PEGuilada), eles inventaram um método que poderia ser facilmente aplicado para estabilizar nanoestruturas de DNA em todas as formas e formas de uma forma escalável. A oligolisina PEGuilada consiste em cadeias curtas do aminoácido positivamente carregado lisina - um dos blocos de construção das proteínas - que estão firmemente ligadas ao polietilenoglicol (PEG), uma molécula polimérica capaz de se ligar a múltiplas cadeias de oligolisina. Os pesquisadores acham que o PEG funciona como uma "escova molecular" para evitar a agregação das nanopartículas neutralizadas.
p Em contraste com Mg individual
2
+
íons que, em teoria, cada um pode neutralizar apenas duas das muitas cargas negativas expostas pelo backbone do DNA com suas duas cargas positivas, A oligolisina PEGuilada pode cobrir várias cargas de DNA negativas de uma só vez, e assim forma uma "rede eletrostática" estável cobrindo a superfície das nanoestruturas de DNA. A estabilidade das nanoestruturas revestidas foi mantida até mesmo em células vivas e camundongos, demonstrando que a equipe estava no caminho certo.
p "Usando esta estratégia simples, poderíamos estender a sobrevivência de nanoestruturas de DNA em cerca de 400 vezes com meia-vida de até 36 horas em ambientes fisiológicos que também continham níveis normais de nuclease, "disse a primeira autora Frances Anastassacos, Ph.D., que na época do estudo era um estudante graduado que trabalhava com Shih. "Contudo, isso ainda ficava aquém do que é necessário em algumas aplicações terapêuticas reais. A oligolisina PEGuilada ainda tendia a cair do DNA em algum grau. "
p No
JACS estude, a equipe agora resolveu essa parte restante do "problema de estabilidade". "Nós essencialmente amarramos nós adicionais na rede eletrostática usando um reagente de reticulação químico conhecido como 'glutaraldeído' que liga fortemente oligolisinas PEGuiladas distintas na superfície das nanoestruturas de DNA, "disse Anastassacos." Na presença de níveis de nuclease de DNA que excedem em muito os do corpo humano, sua sobrevivência se estendeu além de 300 horas. O aumento de 400 vezes na estabilidade que observamos com a oligolisina PEGuilada sozinha foi elevado em mais 250 vezes, que atinge a marca para aplicações clínicas. "
p Outras tentativas que tiveram sucesso em estabilizar nanoestruturas de DNA com modificações químicas dependeram principalmente do redesenho das estruturas existentes para que locais específicos dentro de suas estruturas 3-D se tornassem acessíveis à química implantada. Em contraste, "nossa abordagem pode ser realizada em qualquer nanoestrutura de DNA, e sua facilidade e custo-benefício podem fortalecer significativamente a tradução de muitas estruturas terapêuticas e diagnósticas já existentes e recentemente projetadas, "disse Zhao Zhao, Ph.D., que é o co-autor do estudo e ex-bolsista de pós-doutorado na equipe de Shih.
p Em seu estudo, Shih e sua equipe visavam maximizar a estabilidade das nanoestruturas de DNA. Os pesquisadores, Contudo, pense que, variando ainda mais a etapa de reticulação, a meia-vida das estruturas pode ser ajustada para aplicações específicas que requerem que as moléculas de carga se tornem disponíveis em diferentes momentos e em diferentes intervalos de tempo. Eles já descobriram que seu método de proteção não interferia na ligação de moléculas de carga às estruturas modificadas e na captação das estruturas por células humanas em cultura. Agora, a tradução clínica pode começar.

