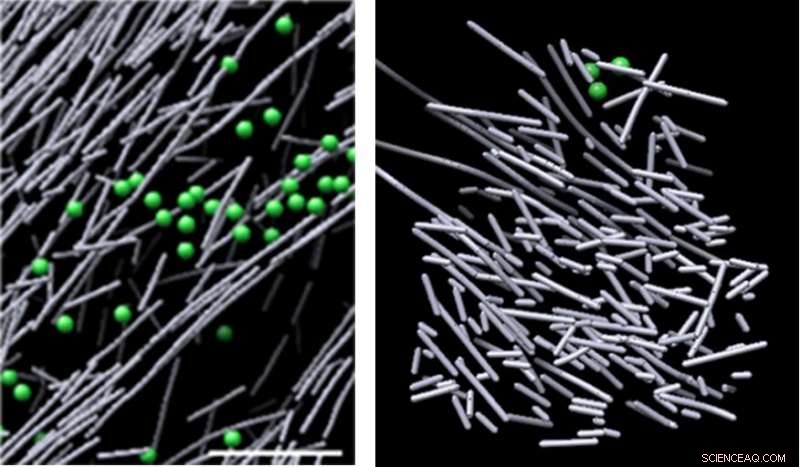
Imagens do microscópio crioeletrônico da montagem de actina na célula na ausência de um sinal molecular (à esquerda) e o nanoescavado de filamento de actina tipo palheiro que foi induzido em resposta a um sinal molecular (Rac1) e promove o movimento celular (à direita). A estrutura apareceu em regiões definidas onde Rac1 foi ativado, e rapidamente se dissipou quando a sinalização Rac1 parou - em apenas dois minutos e meio. Crédito:Sanford Burnham Prebys Medical Discovery Institute (SBP)
Muitas vezes, nossas células precisam se mover. As células móveis orientam a formação do nosso corpo (desenvolvimento embrionário). As células imunológicas vagam para capturar intrusos indesejados. E as células de cura (fibroblastos) migram para curar feridas. Mas nem todo movimento é desejável:os tumores são mais perigosos quando as células cancerosas ganham a capacidade de viajar por todo o corpo (metástase). Certas bactérias e vírus podem aproveitar a maquinaria de motilidade das células para invadir nossos corpos. Compreender como as células se movem - e os filamentos de actina em forma de bastão que conduzem o processo - é a chave para aprender como interromper ou promover a mobilidade para melhorar a saúde humana.
Agora, usando um dos microscópios mais poderosos do mundo, cientistas do Sanford Burnham Prebys Medical Discovery Institute (SBP) e da Universidade da Carolina do Norte em Chapel Hill (UNC-Chapel Hill) identificaram um denso, nanoscaffold de filamento de actina dinâmico e desorganizado - semelhante a um palheiro - que é induzido em resposta a um sinal molecular. Esta é a primeira vez que os pesquisadores visualizaram diretamente, no nível molecular, uma estrutura que é acionada em resposta a um sinal celular - uma descoberta importante que expande nossa compreensão de como as células se movem. O estudo foi publicado no Proceedings of the National Academy of Sciences dos Estados Unidos da América ( PNAS )
"A microscopia ciroeletrônica está revolucionando nossa compreensão do funcionamento interno das células, "diz Dorit Hanein, Ph.D., autor sênior do artigo e professor do Programa de Bioinformática e Biologia Estrutural da SBP. "Essa tecnologia nos permitiu coletar dados robustos, Imagens 3-D de regiões de células - semelhantes à ressonância magnética, que cria imagens detalhadas do nosso corpo. Conseguimos visualizar as células em seu estado natural, que revelou uma nanoarquitetura de actina nunca antes vista dentro da célula. "
No estudo, os cientistas usaram o microscópio crioeletrônico da SBP (Titan Krios), inteligência artificial (AI) e abordagens computacionais e de imagem de células feitas sob medida para comparar imagens em nanoescala de fibroblastos de camundongo com imagens de luz com data e hora de Rac1 fluorescente, uma proteína que regula o movimento celular, resposta à força ou tensão (mecanossensibilização) e invasão de patógenos. Este fluxo de trabalho tecnicamente complexo - que uniu cinco ordens de magnitude em escala (dezenas de mícrons a nanômetros) - levou anos para se desenvolver até seu nível atual de robustez e precisão e foi possível através de esforços experimentais e computacionais das equipes de biólogos estruturais da SBP e a equipe de biossensores da UNC-Chapel Hill.
As imagens revelaram um denso, desorganizado, estrutura tipo andaime composta por hastes curtas de actina. Essas estruturas surgiram em regiões definidas onde Rac1 foi ativado, e rapidamente se dissipou quando a sinalização Rac1 parou - em apenas dois minutos e meio. Este andaime dinâmico contrastou fortemente com vários outros conjuntos de actina em áreas de baixa ativação de Rac1 - alguns compostos de longa, hastes alinhadas de actina, e outros compostos de hastes curtas de actina ramificando-se dos lados de filamentos de actina mais longos. O volume que envolve o andaime de actina era desprovido de estruturas celulares comuns, como ribossomos, microtúbulos, vesículas e mais, provavelmente devido à densidade intensa da estrutura.
"Ficamos surpresos que experimento após experimento revelou esses pontos de acesso únicos de desalinhados, bastonetes de actina densamente empacotados em regiões que se correlacionam com a ativação de Rac1, "diz Niels Volkmann, Ph.D., um co-autor correspondente do artigo que conduziu a parte computacional do estudo, e professor do Programa de Bioinformática e Biologia Estrutural da SBP. "Acreditamos que essa desordem seja, na verdade, a força do andaime - concede flexibilidade e versatilidade para construir maiores, arquiteturas complexas de filamentos de actina em resposta a pistas espaciais locais adicionais. "
Próximo, os cientistas gostariam de expandir o protocolo para visualizar mais estruturas que são criadas em resposta a outros sinais moleculares e desenvolver ainda mais a tecnologia para permitir o acesso a outras regiões da célula.
"Este estudo é apenas o começo. Agora que desenvolvemos este fluxo de trabalho quantitativo em nanoescala que correlaciona o comportamento de sinalização dinâmica com a resolução em nanoescala da crio-tomografia eletrônica, nós e outros cientistas podemos implementar esta ferramenta analítica poderosa não apenas para decifrar o funcionamento interno do movimento celular, mas também para elucidar a dinâmica de muitas outras máquinas macromoleculares em um ambiente celular imperturbado, "diz Hanein.
Ela adiciona, "A actina é uma proteína de bloco de construção; ela interage com mais de 150 proteínas de ligação à actina para gerar diversas estruturas, cada um servindo a uma função única. Temos um excedente de diferentes sinais que gostaríamos de mapear, o que poderia render ainda mais insights sobre como as células se movem. "