Atingir uma placa de Petri de células que continham um vírus modificado com luz vermelha padronizada encorajou a expressão do gene que combinava com o padrão. O experimento de cientistas da Rice University provou a eficácia de um novo sistema de entrega de genes que pode ser controlado com luz. Crédito:Eric Gomez / Rice University
A Light está ajudando os cientistas da Rice University a controlar a infectividade dos vírus e a entrega de genes aos núcleos das células-alvo.
Os pesquisadores desenvolveram um método para usar dois tons de vermelho para controlar o nível e a distribuição espacial da expressão gênica nas células por meio de um vírus modificado.
Embora os vírus tenham evoluído para entregar genes às células hospedeiras, eles ainda enfrentam dificuldades para levar suas cargas úteis do citoplasma para o núcleo de uma célula, onde ocorre a expressão do gene. Os laboratórios Rice dos bioengenheiros Junghae Suh e Jeffrey Tabor encontraram com sucesso uma maneira de superar esse obstáculo crítico.
A pesquisa da equipe aparece esta semana no jornal American Chemical Society ACS Nano .
O resultado dos laboratórios da Rice's BioScience Research Collaborative combina o interesse de Suh em desenvolver vírus para entregar genes a células-alvo com as habilidades de Tabor em optogenética, em que proteínas responsivas à luz podem ser usadas para controlar o comportamento biológico.
Eles construíram vetores de vírus adeno-associados (AAV), incorporando proteínas que se juntam naturalmente quando expostas à luz vermelha (comprimentos de onda de 650 nanômetros) e se separam quando expostas ao vermelho distante (comprimentos de onda de 750 nanômetros). Essas proteínas naturalmente responsivas à luz ajudam os capsídeos virais - as conchas rígidas que contêm cargas genéticas - a entrar nos núcleos da célula hospedeira.
AAV tem sido o vetor de escolha para edição de genes por meio de CRISPR / Cas9, uma técnica que se mostra promissora para a cura de algumas doenças genéticas, mas os núcleos das células apresentam um problema, Suh disse.

O estudante de graduação da Rice University Eric Gomez segura uma máscara em espiral que ele usou para controlar os padrões de expressão de genes em uma placa de Petri. As células da placa continham um vírus modificado que respondeu à luz vermelha e entregou sua carga genética aos núcleos das células. Crédito:Jeff Fitlow / Rice University
"Os vírus em geral são relativamente eficientes na entrega de genes nas células, mas eles ainda enfrentam grandes barreiras limitantes, "disse ela." Se você adicionar esses vírus às células, a maioria deles parece sair do núcleo, e apenas uma pequena fração consegue entrar, qual é o objetivo. "
Ela disse que a equipe baseou-se na experiência do laboratório Tabor em optogenética para aumentar a eficiência dos AAVs. "Jeff trabalha com muitos tipos diferentes de proteínas responsivas à luz. O par específico que decidimos foi identificado pela primeira vez em plantas.
"A luz é muito legal porque você pode aplicá-la externamente e pode controlar muitos aspectos:em quais áreas a luz é exposta, a duração da exposição, a intensidade da luz e, claro, seu comprimento de onda, " ela disse.
O par de proteínas compreende o fitocromo B e seu parceiro de ligação fator de interação com o fitocromo 6 (PIF6), ambos encontrados no agrião. Os pesquisadores geraram células hospedeiras que expressam o fitocromo B marcadas com uma sequência de localização nuclear, um pequeno peptídeo conhecido por ajudar a transportar proteínas para o núcleo de maneira mais eficaz. O PIF6 menor foi então anexado à superfície externa do capsídeo do vírus.
"Quando os vírus são internalizados em uma célula hospedeira, eles se acumulam em torno do núcleo naturalmente, "Suh disse." Sob condições não ativadas, a maioria dos vírus está presa lá. Mas quando acendemos ativando a luz vermelha nas células, essas duas proteínas vegetais dimerizam - elas vêm juntas - e por causa da etiqueta de localização nuclear no fitocromo B, o vírus é arrastado para o núcleo. "
Esta é a primeira vez que proteínas optogenéticas foram usadas para controlar a infecciosidade de vírus, ela disse, adicionando, "Não pensamos que funcionaria tão bem como funcionou."

Junghae Suh, bioengenheira da Rice University, deixou, e o estudante de graduação Eric Gomez liderou um estudo no qual proteínas que respondem à luz ajudaram os capsídeos virais a entregar seu conteúdo aos núcleos das células. Os pesquisadores veem sua técnica como uma forma de controlar a expressão gênica. Crédito:Jeff Fitlow / Rice University
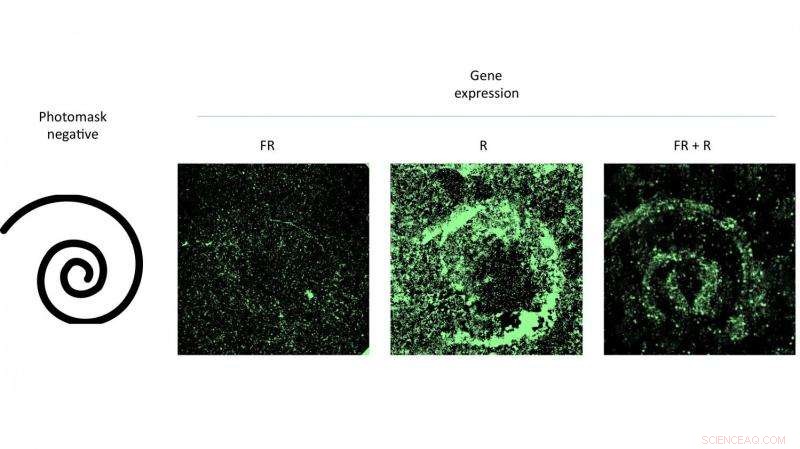
O autor principal Eric Gomez, um estudante de graduação no laboratório de Suh, e co-autor Karl Gerhardt, um estudante de graduação no laboratório de Tabor, demonstraram a técnica ativando padrões de células infectadas com AAV em placas de Petri, iluminando-as com luz vermelha por meio de máscaras.
Suh disse que a plataforma pode ser usada no futuro para controlar quais células e tecidos expressam um gene e em que nível. A estratégia também pode ser usada em aplicações de engenharia de tecidos, como bioscaffolds para implantação. "Aqui, você pode querer persuadir as células-tronco a se desenvolverem nas células certas de alguma forma espacialmente coordenada, " ela disse.
O uso no corpo está mais distante, porque a luz vermelha aplicada externamente só atravessa o tecido para atingir os alvos. "Em última análise, vai depender do dispositivo que você usa para fornecer a luz, "disse ela." Mas imaginamos casos em que você poderia usar um cateter para ir ao local onde deseja que o vírus seja muito mais infeccioso. "
Suh disse que os laboratórios da Rice estão trabalhando para tornar a próxima geração de cápsides mais eficaz e com maior capacidade de entrega. "Este é apenas o primeiro passo, "disse ela." Temos muitas perguntas, como 'Podemos realmente fazer isso in vivo?' tipo de perguntas.
"Tem havido um punhado de documentos tentando fazer o processo infeccioso de vírus responsivo à luz, mas eles eram antes da era da optogenética, "Suh disse." Eles estavam usando outros tipos de moléculas sintéticas para tornar os vírus responsivos à luz.
"Parece que usar o que a Mãe Natureza já forneceu na forma de proteínas responsivas à luz funciona muito bem para nós."