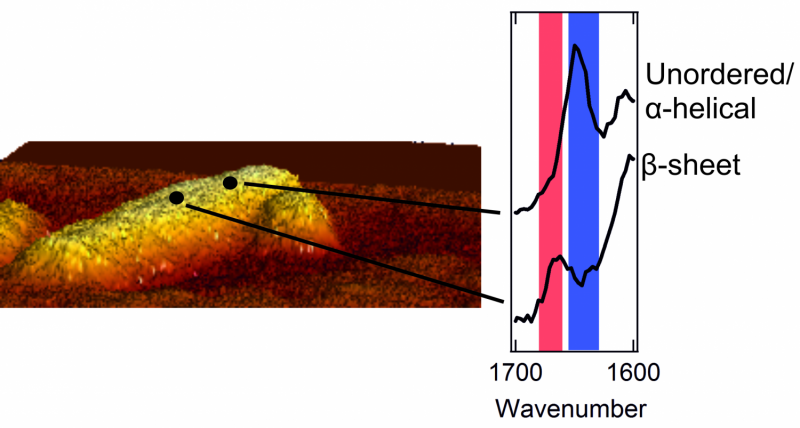
Esquerda:uma imagem de microscópio de força atômica de uma fibrila com um diâmetro de alguns nanômetros. À direita:dois espectros que mostram a estrutura externa. Um pico na área vermelha é característico de um remendo com uma estrutura de folha beta bem ordenada. Um pico na área azul é típico de uma área caótica, estrutura confusa.
Pesquisadores do FOM Institute AMOLF têm, pela primeira vez, conseguiu fazer uma imagem da estrutura externa de um agregado de proteínas que causa doenças como Alzheimer e diabetes tipo 2. Eles descobriram que a superfície externa desses agregados é estruturada de uma maneira muito confusa - muito diferente de seus interiores bem organizados. Os pesquisadores esperam que seu trabalho forneça mais informações sobre a forma como os agregados danificam as células próximas. Os resultados da pesquisa foram publicados online no jornal Pequena em 7 de maio, 2015
Os agregados de proteínas estudados pelos pesquisadores consistem em longos, proteínas dobradas. Os pesquisadores estão familiarizados com a estrutura interna desses agregados (formalmente conhecidos como fibrilas amilóides) há muito tempo. Contudo, com microscópios convencionais, sempre foi impossível ver as estruturas das proteínas na superfície externa dos agregados. Em retrospecto, era como se os pesquisadores estivessem trancados dentro de uma casa. Eles poderiam estudar completamente o interior da casa, mas enquanto eles não tivessem a chave, eles foram incapazes de sair e olhar sua fachada do lado de fora. A descoberta veio quando os pesquisadores criaram essa 'chave' combinando duas técnicas diferentes:microscopia e espectroscopia. Isso permitiu que eles finalmente estudassem a 'alvenaria' externa.
Confuso
p Assim que puderam ter um vislumbre do exterior dos agregados de proteínas, os pesquisadores tiveram uma surpresa. O interior dos agregados é estritamente organizado. As proteínas são organizadas ordenadamente em uma chamada estrutura de folha beta, que forma uma torcida, folha plissada. Contudo, eles descobriram que o exterior do agregado tem uma estrutura muito mais confusa e caótica. Isso é, as proteínas externas formam um desorganizado, padrão irregular. Aqui e alí, existem patches que formam uma estrutura de folha beta, mas em outros lugares essa regularidade não é encontrada em lugar nenhum. Os pesquisadores ainda encontraram diferenças estruturais de um nanômetro para o outro, em uma e na mesma fibrila. p Os pesquisadores também notaram que a estrutura externa de cada fibrila é muito diferente da seguinte. Uma fibrila pode conter muitos patches com uma estrutura de folha beta, enquanto outro não tem esses patches regulares quase completamente. Além disso, os aminoácidos que podem ser encontrados no exterior também diferem para cada fibrila.O exterior bagunçado está em contato direto com as membranas das células vizinhas. Desta maneira, sua estrutura desempenha um papel crucial em danificar essas células. Este tipo de dano celular é comumente encontrado em pacientes com diabetes tipo 2 ou doença de Alzheimer.
A 'chave' que abriu as portas
Os pesquisadores AMOLF colaboraram com seus colegas da Universidade de Utrecht, o Instituto Max Planck para Pesquisa de Polímeros em Mainz, e o Instituto Leibniz de Tecnologia Fotônica em Jena para desenvolver uma nova maneira de visualizar a estrutura protéica externa dos agregados. A chave acabou sendo uma combinação de espectroscopia e microscopia de força atômica.
Um microscópio de força atômica consiste em uma ponta afiada (sonda) que se move sobre a superfície de um objeto. Isso permite que o microscópio explore uma fibrila amilóide em escala atômica e faça um mapa de relevo. Enquanto isso, o espectrômetro mede o chamado espectro Raman para cada pixel do mapa. Esses espectros fornecem informações sobre a forma como as proteínas são dobradas, e a presença de aminoácidos específicos na superfície dos agregados. Os sinais medidos pelo espectrômetro são geralmente fracos, mas uma camada metálica na ponta do microscópio os amplifica muito.
Imagens do exterior das fibrilas amilóides foram feitas antes, mas a equipe agora também imaginou a forma como as proteínas foram dobradas. Primeira autora Corianne van den Akker:"Combinando microscopia e espectroscopia, conseguimos ligar cada pedaço da estrutura a um local no exterior do amiloide. Desta maneira, poderíamos fazer uma imagem com resolução em nanoescala, bem como determinar a estrutura de cada local. Essa é a façanha única da técnica que usamos. "
O próximo passo
Com o conhecimento recém-adquirido, será possível medir a estrutura das amilóides que se formaram no exterior das células vivas também. A técnica também pode ser usada para testar medicamentos que visam prevenir ou dissolver agregados de proteínas.