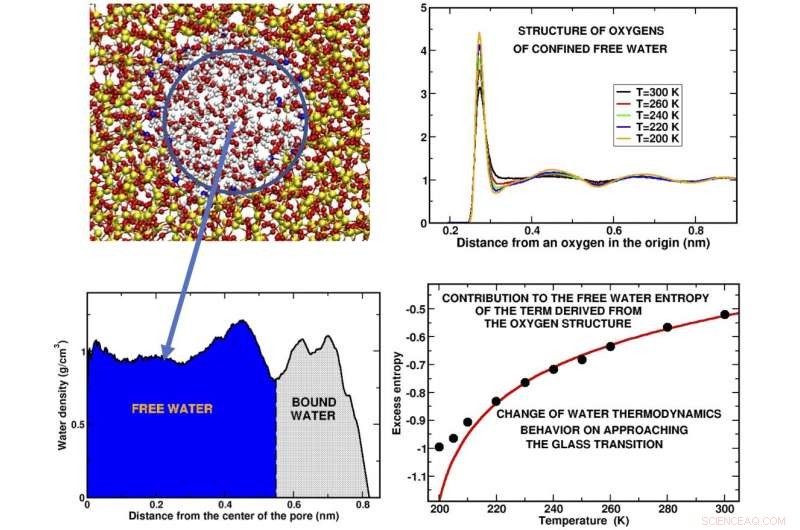
Painel superior esquerdo:instantâneo de uma fatia de água confinada no poro de sílica. O círculo azul contém a 'água livre, 'as moléculas de água que não estão em contato com o substrato.Painel inferior esquerdo:Perfil de densidade das moléculas de água ao longo do raio dos poros. As regiões ocupadas respectivamente pela água livre e pela "água ligada, "água ligada ao substrato, são indicados. Painel superior direito:As curvas representam como os átomos de oxigênio das moléculas são organizados em camadas ao redor de um determinado átomo de oxigênio na origem em diferentes temperaturas. Os picos representam as posições onde as diferentes cascas estão localizadas. A estrutura é mostrada para algumas das temperaturas super-resfriadas investigadas. Painel inferior direito:O principal resultado de nossa simulação de computador é dado pelo comportamento do excesso de entropia, uma fração da entropia total, obtido a partir da estrutura de oxigênio da água livre. O desvio dos pontos pretos calculados da curva teórica (vermelha) indica que a água sofre uma mudança de comportamento antes e ao se aproximar da transição vítrea. Crédito:Margherita De Marzio, Gaia Camisasca, Maria Martin Conde, Mauro Rovere e Paola Gallo
Existem poucas coisas mais importantes para a vida na Terra do que a água. Domina a paisagem física, cobrindo grande parte do planeta como oceanos. É também um componente importante do corpo humano, composta, por exemplo, mais de 70% da massa de um bebê recém-nascido.
No entanto, apesar de sua onipresença, a água tem muitas propriedades físicas que ainda não são totalmente compreendidas pela comunidade científica. Uma das mais intrigantes está relacionada à atividade das moléculas de água depois que elas passam por um processo chamado "superresfriamento".
Agora, novas descobertas da Roma Tre University, em Roma, Itália, sobre as interações das moléculas de água sob essas condições exóticas aparecem esta semana no Journal of Chemical Physics .
"Normalmente, quando a água líquida é resfriada abaixo de seu ponto de congelamento, as moléculas de água se organizam em ordem, estrutura de cristal que é gelo, "disse Paola Gallo, professor associado de física na Roma Tre University. "Com super-resfriamento, técnicas especiais são empregadas para resfriar a água muito rapidamente, de forma que ela permaneça líquida mesmo que sua temperatura tenha baixado bem abaixo do ponto de congelamento. Há uma série de anomalias na atividade das moléculas de água nessas condições super-resfriadas que ainda não foram totalmente explicadas. "
Usando uma simulação baseada em computador, Gallo e seus colegas lançam luz sobre uma propriedade termodinâmica da água que ajuda a explicar como as moléculas de água em um estado super-resfriado interagem umas com as outras e com as moléculas de outros materiais.
"Embora o super-resfriamento seja um fenômeno importante para estudar, o desafio é que é muito difícil superresfriar a água em um laboratório, "disse Gallo.
No passado, os cientistas tentaram resolver esse problema super-resfriando a água "em confinamento, "concentrar esforços no estudo de água confinada em poros fabricados com um raio de alguns namômetros (ou seja, uma ou duas ordens de magnitude maior do que o diâmetro da molécula de água). Contudo, levantou a questão de saber se as propriedades desta água confinada diferem das da água a granel, onde as moléculas de água interagem livremente em volumes maiores.
"Esta questão tem sido um ponto de interesse contínuo em nosso trabalho, "disse Gallo." Em estudos anteriores, mostramos que as interações com outros produtos químicos afetam apenas as moléculas de água que estão fisicamente muito próximas das moléculas de outro produto químico, como as moléculas que constituem a parede do poro. As moléculas de água no centro do poro, a água grátis, retém muitas das propriedades da água em massa. "
"Com este estudo, descobrimos que existem outros paralelos, "Gallo também disse." Especificamente, nossa simulação mostra que uma propriedade da estrutura da rede de moléculas de água, que pode ser medido e verificado experimentalmente, pode ser usado para determinar as mudanças na entropia da água, a quantidade termodinâmica que mede a desordem em um sistema [...] que pode oferecer insights sobre algumas das facetas termodinâmicas mais incomuns da atividade da água neste estado super-resfriado. "
Essas descobertas criam uma estrutura para outros físicos experimentais recriarem a simulação com amostras físicas em um laboratório. Para Gallo e seus colegas, seu trabalho oferece uma base para uma investigação mais aprofundada das relações entre as características termodinâmicas da água confinada e da água a granel.
“A água é o líquido mais importante que temos na terra, "explicou Gallo." Quaisquer percepções que os pesquisadores possam descobrir sobre suas propriedades podem avançar não apenas nosso entendimento coletivo da física, mas também de biologia e química, e abrir novas possibilidades de integração desse conhecimento em diferentes aplicações tecnológicas. ”