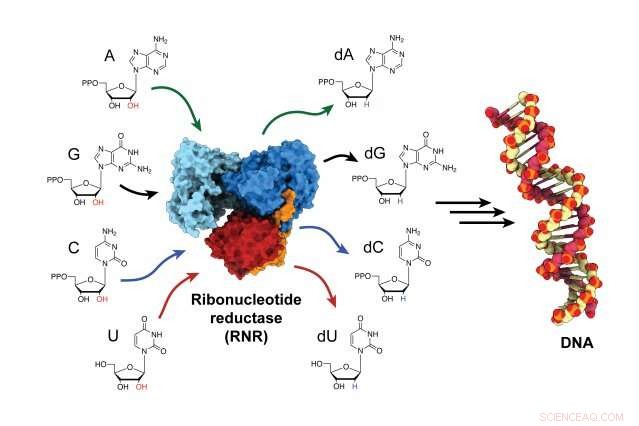
A enzima ribonucleotídeo redutase (RNR) é responsável por converter blocos de construção de RNA em blocos de construção de DNA, e é um ator crítico tanto na síntese quanto no reparo do DNA em todos os organismos. Crédito:Gyunghoon "Kenny" Kang
Como você captura um processo celular que ocorre em um piscar de olhos? Os bioquímicos do MIT desenvolveram uma maneira de capturar e visualizar uma enzima vital no momento em que ela se torna ativa - informando o desenvolvimento de medicamentos e revelando como os sistemas biológicos armazenam e transferem energia.
A enzima, ribonucleotídeo redutase (RNR), é responsável por converter blocos de construção de RNA em blocos de construção de DNA, a fim de construir novos filamentos de DNA e reparar os antigos. RNR é um alvo para terapias anticâncer, bem como medicamentos que tratam doenças virais como HIV / AIDS. Mas por décadas, os cientistas se esforçaram para determinar como a enzima é ativada porque isso acontece muito rapidamente. Agora, pela primeira vez, pesquisadores prenderam a enzima em seu estado ativo e observaram como a enzima muda de forma, aproximando suas duas subunidades e transferindo a energia necessária para produzir os blocos de construção para a montagem do DNA.
Antes deste estudo, muitos acreditaram que as duas subunidades de RNR se juntaram e se encaixaram com simetria perfeita, como uma chave em uma fechadura. "Por 30 anos, isso é o que pensamos, "diz Catherine Drennan, professor de química e biologia do MIT e investigador do Howard Hughes Medical Institute. "Mas agora, podemos ver que o movimento é muito mais elegante. A enzima está na verdade realizando uma 'quadrilha molecular, 'onde diferentes partes da proteína se ligam e giram em torno de outras partes. É realmente muito bonito. "
Drennan e JoAnne Stubbe, professora emérita de química e biologia do MIT, são os autores seniores do estudo, que apareceu no jornal Ciência em 26 de março. O ex-aluno de graduação Gyunghoon "Kenny" Kang Ph.D. '19 é o autor principal.
Todas as proteínas, incluindo RNR, são compostos de unidades fundamentais conhecidas como aminoácidos. Por mais de uma década, O laboratório de Stubbe tem feito experiências com a substituição dos aminoácidos naturais de RNR por sintéticos. Ao fazer isso, o laboratório percebeu que poderia aprisionar a enzima em seu estado ativo e retardar seu retorno ao normal. Contudo, não foi até o laboratório Drennan ganhar acesso a um avanço tecnológico chave - microscopia crioeletrônica - que eles puderam capturar imagens de alta resolução dessas enzimas "presas" do laboratório Stubbe e dar uma olhada mais de perto.
"Nós realmente não tínhamos feito nenhuma microscopia crioeletrônica no ponto em que começamos ativamente a tentar fazer o impossível:colocar a estrutura do RNR em seu estado ativo, "Drennan diz." Eu não posso acreditar que funcionou; Eu ainda estou me beliscando. "
A combinação dessas técnicas permitiu à equipe visualizar a complexa dança molecular que permite à enzima transportar o "poder de fogo" catalítico de uma subunidade para a próxima, a fim de gerar blocos de construção de DNA. Este poder de fogo é derivado de um elétron desemparelhado altamente reativo (um radical), que deve ser cuidadosamente controlada para evitar danos à enzima.
De acordo com Drennan, a equipe "queria ver como a RNR faz o equivalente a brincar com fogo sem se queimar".
O primeiro autor, Kang, diz que desacelerar a transferência radical permitiu que observassem partes da enzima que ninguém havia sido capaz de ver antes na íntegra. "Antes deste estudo, sabíamos que essa dança molecular estava acontecendo, mas nunca tínhamos visto a dança em ação, "ele diz." Mas agora que temos uma estrutura para RNR em seu estado ativo, temos uma ideia muito melhor sobre como os diferentes componentes da enzima estão se movendo e interagindo para transferir o radical por longas distâncias. "
Embora esta dança molecular reúna as subunidades, ainda há uma distância considerável entre eles:o radical deve viajar 35-40 angstroms da primeira subunidade para a segunda. Esta viagem é cerca de 10 vezes mais longe do que a transferência radical média, de acordo com Drennan. O radical deve então viajar de volta ao seu ponto de partida e ser armazenado com segurança, tudo dentro de uma fração de segundo antes que a enzima retorne à sua conformação normal.
Como o RNR é um alvo para drogas que tratam o câncer e certos vírus, conhecer sua estrutura de estado ativo pode ajudar os pesquisadores a conceber tratamentos mais eficazes. Compreender o estado ativo da enzima também pode fornecer informações sobre o transporte biológico de elétrons para aplicações como biocombustíveis. Drennan e Kang esperam que seu estudo incentive outros a capturar eventos celulares fugazes que foram difíceis de observar no passado.
"Podemos precisar reavaliar décadas de resultados anteriores, "Drennan diz." Este estudo pode abrir mais perguntas do que respostas; é mais um começo do que um fim. "
Esta história foi republicada por cortesia do MIT News (web.mit.edu/newsoffice/), um site popular que cobre notícias sobre pesquisas do MIT, inovação e ensino.