Uma ilustração da reação química desenvolvida no estudo. Crédito:J. Waser / B. Fierz (EPFL)
Compreender a estrutura e o metabolismo das células e organismos vivos é essencial para o desenvolvimento de novos medicamentos e diagnósticos. A disponibilidade de ferramentas químicas que permitem aos cientistas editar biomoléculas, como proteínas, com resolução em nível de átomo têm contribuído muito para o progresso da biologia química.
As proteínas são macromoléculas construídas a partir de um conjunto de vinte aminoácidos quimicamente diferentes. Uma abordagem chave para modificar proteínas é reagir com o átomo de enxofre no aminoácido cisteína. Contudo, os métodos atuais ainda são problemáticos em termos de eficiência, seletividade, e estabilidade do produto final (o "aduto").
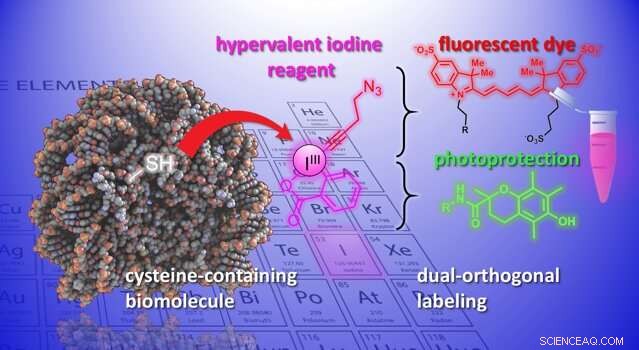
Agora, os laboratórios de Jérôme Waser e Beat Fierz no Instituto de Ciências Químicas e Engenharia da EPFL desenvolveram um novo método para modificar cisteínas em peptídeos e proteínas. O método usa um grupo de moléculas orgânicas altamente reativas, as etinilbenziodoxolonas (EBXs). O que torna os EBXs altamente reativos é que eles contêm um átomo de iodo ligado a três grupos substituintes. Esta situação não natural leva a uma alta reatividade nesses reagentes chamados de "iodo hipervalente".
Pela primeira vez, os pesquisadores foram capazes de gerar um aduto de biomolécula-EBX simples, mantendo seu grupo de iodo reativo na molécula final. A reação pode ser facilmente realizada por um não especialista em condições fisiológicas padrão.
O produto final são quimeras de reagente de iodo hipervalente de proteína que podem atuar como pontos de fixação duplos para dois novos grupos químicos, abrindo novas oportunidades para o estudo dos processos biológicos.
"Uma nova funcionalidade pode ser introduzida por meio da 'química do clique, 'uma reação bem estabelecida em biologia química, "diz Waser." Usando um catalisador de paládio, outra modificação seletiva pode ser alcançada no átomo de iodo reativo - o que chamaríamos de funcionalidade "bi-ortogonal", já que não existe na natureza. "A introdução de tais grupos reativos exóticos em biomoléculas é atualmente uma das ferramentas mais importantes da biologia química, pois permite o estudo dos processos biológicos sem interferir neles.
Os cientistas demonstraram o potencial do método, introduzindo um conjunto diversificado de grupos químicos em biomoléculas. Por exemplo, os cientistas usaram a alça dupla para anexar um corante fluorescente e um grupo fotoprotetor em um neuropeptídeo simultaneamente. Combiná-los melhora a fotoestabilidade do corante, e permite alta resolução, imagem de uma única molécula de interações moleculares.
Além dos peptídeos, eles modificaram ainda pequenas proteínas, e até mesmo grandes complexos de proteína-DNA, os chamados nucleossomos. À medida que os nucleossomos organizam o genoma, rotulá-los com corantes fluorescentes pode ajudar a rastreá-los para decifrar como a natureza regula a expressão gênica.
"O que desenvolvemos aqui é um novo método para modificar proteínas com base em estudos fundamentais de reatividade química, "diz Fierz." Já o usamos para modificar histonas, e realizaram experimentos de fluorescência em células vivas. Com esses exemplos, estabelecemos as bases para uma melhor compreensão dos processos biológicos. "
O estudo é publicado em Chem hoje.