A transferência de hidreto é uma reação importante para a química (por exemplo, células de combustível), bem como biologia (por exemplo, cadeia respiratória e fotossíntese). Muitas vezes, uma reação parcial envolve a transferência de um íon hidreto (H−). Mas essa transferência de hidreto envolve uma etapa ou várias etapas individuais? No jornal Angewandte Chemie , os cientistas já forneceram a primeira prova de transferência gradual de hidreto em um sistema biológico.
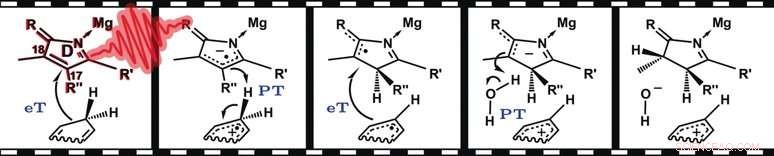
Uma etapa importante na biossíntese da clorofila é a hidrogenação dependente da luz da protoclorofilida em clorofilida. Isso envolve a redução de uma ligação dupla entre os átomos de carbono 17 e 18 neste sistema de anel complexo a uma ligação simples, pois ambos os átomos de carbono se ligam a um átomo de hidrogênio adicional. Esta etapa é catalisada pela enzima protoclorofilida oxirredutase e requer irradiação com luz. Tecnicamente falando, Contudo, esta reação não adiciona um átomo de hidrogênio a cada carbono. Em vez de, há a primeira adição de um íon hidreto (H–) ao C 17 e então a adição de um próton (H +) a C 18 . A primeira reação parcial, a transferência de hidreto, requer o cofator nicotinamida adenina dinucleotídeo fosfato (NADPH). O NADPH serve como fonte para dois elétrons e um próton (H +), o equivalente a um ânion hidreto, H–.
As reações de transferência de hidretos desempenham um papel fundamental em muitos sistemas biológicos. Contudo, seu mecanismo ainda é contestado. Faça as três etapas elementares - transferência de um elétron, um próton, e outro elétron do NADPH para o substrato - ocorrem simultaneamente, ou passo a passo?
Por causa da curta vida útil dos intermediários, a prova direta de um mecanismo passo a passo não era possível anteriormente. Reações dependentes de luz - como a hidrogenação que ocorre na biossíntese da clorofila - que podem ser desencadeadas por um curto pulso de laser resolveram esse problema. Usando espectroscopia de absorção e emissão resolvida no tempo, pesquisadores trabalhando com Roger J. Kutta e Nigel S. Scrutton na Universidade de Manchester (Reino Unido) foram capazes de caracterizar o mecanismo dessa transferência de hidreto.
Além dos estados de excitação da protoclorofilida, os pesquisadores foram capazes de resolver três intermediários discretos que são consistentes com um mecanismo parcialmente gradual:uma transferência inicial de elétrons de NADPH para protoclorofilida que foi excitada (para o estado singlete) pela luz é seguida pela transferência acoplada de um próton e um elétron . Como esperado, a etapa final é a transferência do segundo próton.
Interessantemente, os pesquisadores encontraram diferentes intermediários para o tipo selvagem da enzima e uma versão mutada (C 226 S):Enquanto o hidreto inicial se liga a C 17 no tipo selvagem, é transferido para C 18 na versão mutante. Contudo, o resultado final é o mesmo estereoisômero de clorofilida.
Os insights obtidos com esses experimentos fornecem uma compreensão mais profunda de como a energia da luz pode ser usada para reações químicas envolvendo a transferência de hidrogênio, particularmente no que diz respeito ao projeto de catalisadores ativados por luz.