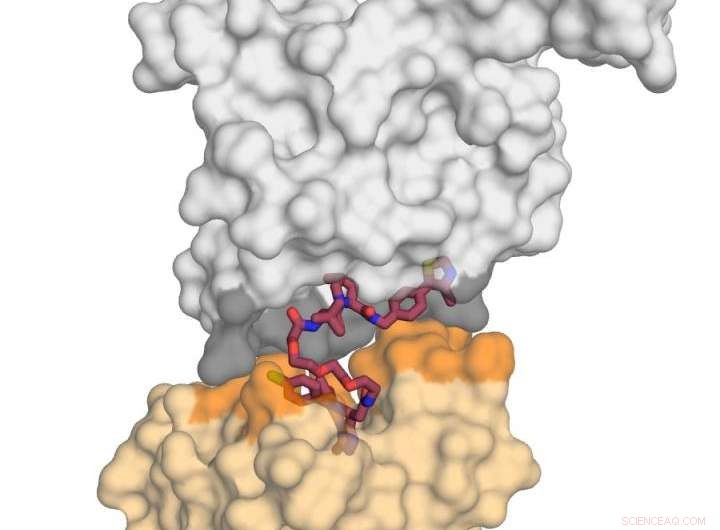
A imagem mostra a proteína ligase E3 VHL (em cinza) em complexo com a pequena molécula MZ1 (em framboesa) e 'beijando' a proteína BRD4 (em amarelo). Ao receber este 'beijo' mortal, BRD4 é direcionado para degradação. Crédito:Xavier Lucas, Alessio Ciulli, Universidade de Dundee
Cientistas da Universidade de Dundee relataram um grande avanço no direcionamento às causas de muitas doenças, usando um 'beijo da morte' para destruir proteínas que antes eram consideradas 'não passíveis de remédio'.
Muito se sabe sobre proteínas como Ras e Myc, que são conhecidas por serem culpadas no câncer humano, e Huntingtin, que causa a doença de Huntingdon, mas até agora eles se mostraram teimosamente resistentes aos esforços para encontrar maneiras de enfrentá-los com drogas.
Agora, os pesquisadores liderados pelo professor Alessio Ciulli na Escola de Ciências da Vida de Dundee encontraram uma maneira de direcionar proteínas semelhantes, usando uma abordagem de molécula pequena de uma forma não convencional para direcionar proteínas "ruins", ligando-as a agentes neutralizantes para iniciar um processo de degradação, e, assim, removendo-os inteiramente.
“Sabemos de muitas proteínas que são ativas em causar doenças, mas que não conseguimos impedir de se tornarem 'desonestos' ou impedi-los quando o fizerem, "disse o professor Ciulli.
"O maior problema é que não conseguimos encontrar as pequenas moléculas que podem se ligar com sucesso a essas proteínas e, ao mesmo tempo, dificultar sua função. É uma área altamente complexa - essas proteínas muitas vezes podem enganar os reguladores dentro da célula e ser extremamente difícil de definir com inibidores.
"A pesquisa em nosso laboratório nos últimos anos contribuiu para estabelecer uma abordagem diferente, um que foi teorizado por muitos anos, mas que só agora é totalmente realizado por este último trabalho. Em vez de usar a pequena molécula para tentar desativar a proteína ruim, desenvolvemos uma forma de modificá-lo para que possa ser usado para atrair as proteínas neutralizantes, que então se ligam ao seu vizinho mau e agem contra ele, iniciando um processo em cascata de degradação.
"Crucialmente, também descobrimos que não é suficiente para esta proteína neutralizante ficar perto da proteína ruim, tem que fazer contato direto com ele, para 'beijá-lo'. E não apenas um beijinho, mas um verdadeiro abraço 'E o Vento Levou'. Chamamos isso de 'beijo da morte', pois é a chave para garantir a degradação da proteína ruim. "
O professor Ciulli e seus colegas concentraram sua atenção em uma molécula degradante química bivalente chamada `PROTAC '(moléculas quiméricas direcionadas à proteólise). Eles foram capazes de criar a primeira estrutura de cristal de raios-X de um PROTAC ligado à proteína 'ruim' e ao agente 'neutralizante' (uma ubiquitina ligase E3), e descobri que pode ser implantado com sucesso como um 'ímã' para atrair as duas proteínas-alvo juntas.
"Esta descoberta fornece os primeiros insights sobre como funcionam os PROTACs e como podemos direcionar proteínas para degradação de uma maneira altamente seletiva, "disse o professor Ciulli.
"Isso representa uma mudança de paradigma em como podemos garantir a intervenção química seletiva contra proteínas que sabemos serem fatores causadores de doenças, mas que até agora têm sido impossíveis de combater com sucesso. Isso aponta para a possibilidade de drogar o 'indestrutível'."
Os resultados da pesquisa são publicados na revista. Nature Chemical Biology .
O trabalho realizado pela equipe de Dundee se concentrou no emparelhamento de uma das proteínas do bromodomínio BET, BRD4, que é um alvo atraente de drogas para o câncer, com um 'degradador' BRD4 seletivo chamado MZ1. Eles descobriram que o MZ1 poderia juntar as duas proteínas dobrando-se em si mesmo. Uma vez que as duas proteínas são unidas em seu 'beijo', as interações entre elas levam à degradação do alvo. Eles mostraram como as proteínas semelhantes BRD2 e BRD3 não beijam a proteína neutralizante também, e guiados por essas informações, eles foram capazes de projetar novos degradadores que poupam essas proteínas completamente do processo de degradação. Isso é importante porque elucida como moléculas degradantes podem ser projetadas no futuro para minimizar os efeitos fora do alvo de maneiras que podem não ser possíveis com o uso de inibidores convencionais.
A equipe de Dundee que trabalhava no projeto incluía pesquisadores de pós-doutorado no laboratório do professor Ciulli, Morgan Gadd, Andrea Testa, Xavier Lucas e Kwok-Ho Chan, e Wengzhan Chan e Dougie Lamont do Dundee Fingerprints Proteomics Facility.
O professor Ciulli disse que já existem sinais promissores por parte da indústria farmacêutica de investimentos significativos nesta área de investigação.
"Agora entendemos melhor como transformar inibidores em degradantes. O caminho para transformar agentes degradantes em drogas será longo e tortuoso e não podemos chegar lá por conta própria. É empolgante ver sinais de sério compromisso da indústria farmacêutica, o que aumenta o otimismo de que seremos capazes de chegar a um ponto em que poderemos drogar o `indestrutível '."