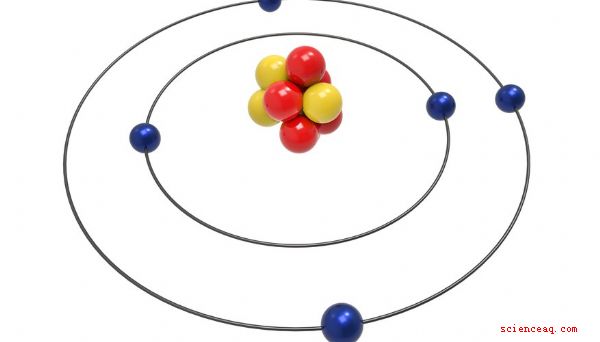
Átomos compõem toda a matéria. Tudo com massa e volume, grande ou pequeno, contém átomos. Surpreendentemente, os átomos minúsculos contêm partículas ainda menores. Prótons, nêutrons e elétrons são os três principais componentes de todos os átomos. O número e o arranjo dessas três partículas inimaginavelmente pequenas determinam as propriedades e o comportamento dos átomos que as contêm.
TL; DR (muito longo; não leu)
Para encontrar o número de nêutrons em um isótopo, subtraia o número de prótons da massa atômica do isótopo. O número atômico do elemento é igual ao número de prótons. Calcular o número de nêutrons torna-se massa atômica do isótopo menos o número atômico do elemento é igual ao número de nêutrons. Para o urânio-235, número atômico 92, o número de nêutrons é 235-92 \u003d 143, ou 143 nêutrons.
Partículas em Átomos
Quase todos os átomos contêm três partículas principais: prótons, nêutrons e elétrons. Prótons e nêutrons compõem o núcleo, ou centro, do átomo. Os elétrons, muito menores que os prótons e nêutrons, circundam o núcleo, zunindo na velocidade da luz. Os prótons têm uma carga positiva, os nêutrons não têm carga e os elétrons têm uma carga negativa. Em um átomo neutro, o número de prótons é igual ao número de elétrons, mas o número de nêutrons nem sempre é igual ao número de prótons.
Identificando átomos
O número de prótons em um átomo determina quais tipo de elemento que o átomo forma. O hidrogênio, primeiro elemento da tabela periódica, possui apenas um próton. O hélio, o segundo na tabela periódica, possui dois prótons. O ouro, número 79 da tabela periódica, possui 79 prótons. A Tabela Periódica de Elementos mostra os elementos em ordem do número de prótons nos átomos.
Isótopos de átomos
Um isótopo de um elemento significa átomos com o mesmo número atômico, mas com diferentes números de massa. Portanto, os isótopos de um elemento têm um número diferente de nêutrons. O hidrogênio, a forma mais comum do átomo, possui um próton e um elétron. O deutério, um isótopo de hidrogênio, ainda possui apenas um próton e um elétron, mas também um nêutron. O trítio, outro isótopo de hidrogênio, ainda possui apenas um próton e um elétron, mas possui dois nêutrons.
Cálculo de nêutrons
A massa de um átomo consiste nas massas combinadas de prótons e nêutrons. A massa dos elétrons é desprezível na massa total do átomo. Os prótons medem cerca de uma unidade de massa atômica e os nêutrons medem apenas um pouco mais de uma unidade de massa atômica. Para encontrar o número de nêutrons no átomo, subtraia o número atômico da massa atômica.
O número atômico e a massa atômica média podem ser encontrados na tabela periódica. A massa de diferentes isótopos é frequentemente escrita como parte do nome do isótopo. Urânio-235 significa que o elemento urânio, número atômico 92, possui 92 prótons e uma massa atômica de 235. Por outro lado, o urânio-238 possui massa de 238, mas ainda possui apenas 92 prótons. Um método alternativo de escrever um isótopo mostra a massa atômica como um sobrescrito e o número atômico como um subscrito. O urânio-235 também pode ser escrito como 235 U, onde U é a abreviação padrão para urânio.
Usando os isótopos de hidrogênio como exemplos, o átomo "normal" de hidrogênio tem uma massa atômica de 1, e o número atômico é 1, significando que o átomo possui apenas um próton. Usando a fórmula, a massa atômica de 1 menos o número atômico, ou número de prótons, de 1 fornece a equação 1-1 \u003d 0, de modo que o átomo de hidrogênio tem 0 nêutrons. Por outro lado, o trítio, um isótopo de hidrogênio, tem uma massa atômica de 3, mas o número atômico de hidrogênio permanece 1 porque o átomo possui apenas um próton. Usando a equação, a massa atômica menos o número atômico é igual ao número de nêutrons, dá 3-1 \u003d 2, então o trítio possui 2 nêutrons.
Outro elemento comum, o carbono, também possui vários isótopos. O átomo de carbono normal, número atômico 6, tem uma massa atômica de 12. Usando a fórmula, a massa atômica menos o número atômico é igual ao número de nêutrons, mostra 12-6 \u003d 6, então o átomo de carbono-12 possui 6 nêutrons. O carbono-14, usado para datação por idade radioativa de fósseis com menos de 10.000 anos de idade, ainda possui 6 prótons, mas possui uma massa atômica de 14. O cálculo do número de nêutrons usa a mesma fórmula, então 14-6 \u003d 8, então o carbono-14 tem 8 nêutrons em seu núcleo.