 p Resumo gráfico. Crédito:DOI:10.1038 / s41589-021-00844-0
p Resumo gráfico. Crédito:DOI:10.1038 / s41589-021-00844-0
p Apesar dos avanços médicos notáveis nos últimos anos, a fibrose cística continua a ser a doença genética letal mais prevalente. É devido a mutações na proteína CFTR, que normalmente é necessária para manter o equilíbrio adequado de fluidos em órgãos-chave, como os pulmões, pâncreas ou sistema digestivo. p Na maioria dos casos, a mutação causadora, chamado F508del, envolve apenas um dos 1.480 aminoácidos que constituem a proteína CFTR. Esta mudança aparentemente pequena leva a fortes efeitos deletérios na proteína, que se torna incapaz de realizar sua função biológica normal, levando ao surgimento da doença. Por anos, pesquisadores tentaram entender como e por que uma simples mutação desencadeia efeitos tão grandes na estrutura e função da proteína, com consequências dramáticas para os pacientes.
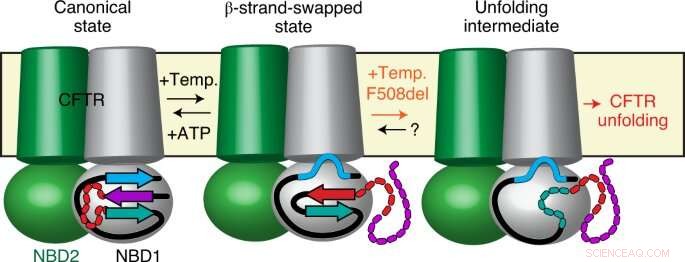
p Usando uma combinação de métodos de ponta, como fluorescência de molécula única, Cristalografia de raio-x, troca de hidrogênio-deutério e eletrofisiologia de molécula única, pesquisadores liderados por Cédric Govaerts - Laboratoire Structure &Fonction des membranes biologiques, Faculté des Sciences, Université libre de Bruxelles - descobriram um fenômeno completamente novo no CFTR:enquanto as proteínas devem adotar uma única conformação que permite uma única função biológica, eles observaram uma nova conformação de CFTR.
p Esta estrutura não havia sido observada antes e demonstra que CFTR não é uma molécula fixa, mas pode alternar entre (pelo menos) duas conformações diferentes com funções potencialmente diferentes.
p Surpreendentemente, pesquisadores também observaram que a mutação mais prevalente, F508del, não afeta as próprias estruturas, mas sim as transições entre eles. Em outras palavras, eles propõem que mutações causadoras de doenças, como F508del, não podem, como se acreditava anteriormente, perturbar a conformação final da proteína, mas, ao invés da dinâmica, especificamente a capacidade da proteína de trocar entre diferentes estados dentro da célula.
p Essa observação muda nossa compreensão da biologia CFTR e da fibrose cística. Além disso, seu fenômeno poderia se aplicar a outras proteínas e, assim, permitir o entendimento de outras doenças genéticas.
