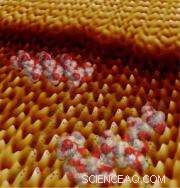
Modelos de peptídeos e a estrutura cristalina do monohidrato de oxalato de cálcio em uma imagem de microscópio de força atômica coletada durante o crescimento do cristal. A borda inferior desta imagem tem cerca de 60 átomos de diâmetro. (Imagem cortesia de Jim DeYoreo, et. al)
(PhysOrg.com) - Cientistas do Berkeley Lab's Molecular Foundry imaginaram o crescimento de superfícies minerais salpicadas de proteínas com resolução sem precedentes e forneceram um vislumbre de como os sistemas vivos projetam materiais estruturais importantes.
Cientistas da Fundição Molecular do Laboratório Nacional Lawrence Berkeley imaginaram o crescimento de superfícies minerais salpicadas de proteínas com resolução sem precedentes, fornecendo um vislumbre dos principais materiais estruturais desenvolvidos por sistemas vivos. A técnica de alta resolução da equipe revela os mecanismos naturais empregados por criaturas no mar e na costa, e poderia fornecer um meio de observar e orientar o crescimento desse cristal à medida que ele ocorre.
Por milhões de anos, organismos de algas a humanos têm usado a biomineralização - o processo de organização de minerais como carbonato de cálcio em sistemas biológicos - para gerar conchas, espinhos, ossos e outros materiais estruturais. Recentemente, pesquisadores começaram a desvendar a estrutura e composição desses biominerais. Contudo, compreender como as biomoléculas interagem com os minerais para formar essas arquiteturas complexas continua sendo um desafio formidável, pois requer resolução em nível molecular e recursos de imagem rápida que não perturbam ou alteram o ambiente local.
Vídeo:Filme de microscopia de força atômica mostra um peptídeo adsorvido a uma superfície de cristal enquanto duas etapas sucessivas de cristal interagem, então progrida além do peptídeo. O peptídeo retarda temporariamente a etapa antes de transferir até a próxima camada atômica. O padrão de rede na superfície corresponde à estrutura molecular do cristal subjacente.
Força atômica microscópica, que rastreia colinas e vales em escala nanométrica através do terreno de um cristal com uma sonda afiada, é freqüentemente usado para estudar superfícies. As deflexões que uma sonda encontra em um material são traduzidas em sinais elétricos e então usados para criar uma imagem da superfície. Contudo, um ato de equilíbrio cuidadoso é necessário para manter a resolução fornecida por uma sonda afiada e a flexibilidade necessária para deixar as moléculas biológicas suaves imperturbadas. Agora, Os pesquisadores da Molecular Foundry desenvolveram uma ferramenta capaz de discernir materiais biológicos delicados e ondulações mínimas na superfície de um cristal, tudo isso enquanto observam o processo de mineralização na presença de proteínas.
“Nós encontramos uma abordagem para criar imagens consistentes de macromoléculas macias em uma superfície de cristal duro com resolução molecular, e fizemos isso em solução e em temperatura ambiente, que é muito mais aplicável a ambientes naturais, ”Diz Jim DeYoreo, vice-diretor da Fundição Molecular, uma instalação do usuário nacional do Departamento de Energia dos Estados Unidos localizada em Berkeley Lab que fornece suporte a pesquisadores de nanociência em todo o mundo.
“Com essas sondas híbridas, podemos literalmente assistir as biomoléculas interagirem com a superfície do cristal enquanto o cristal cresce um passo atômico de cada vez. Ninguém conseguiu acompanhar esse processo com esse tipo de resolução até agora, ”Diz Raymond Friddle, um bolsista de pós-doutorado no Laboratório Nacional Lawrence Berkeley.
DeYoreo, Friddle, co-autores Matt Weaver e Roger Qiu (Laboratório Nacional Lawrence Livermore), Bill Casey (Universidade da Califórnia, Davis) e Andrzej Wierzbicki (University of Southern Alabama), usaram essas sondas de microscópio de força atômica ‘híbrida’ para estudar as interações entre um cristal crescente de monohidrato de oxalato de cálcio, um mineral presente em cálculos renais humanos, e peptídeos, moléculas de polímero que realizam funções metabólicas em células vivas. Essas sondas híbridas combinam nitidez e flexibilidade, o que é crucial para atingir a velocidade e resolução necessárias para monitorar o crescimento do cristal com o mínimo de perturbação para os peptídeos.
As descobertas da equipe revelam um processo complexo. Em uma faceta carregada positivamente do monohidrato de oxalato de cálcio, os peptídeos formam um filme que atua como um interruptor para ligar ou desligar o crescimento do cristal. Contudo, em uma faceta carregada negativamente, os peptídeos se acotovelam na superfície para criar aglomerados que desaceleram ou aceleram o crescimento do cristal.
“Nossos resultados mostram que os efeitos dos peptídeos em um cristal em crescimento são muito mais complicados do que os mais simples, pequenas moléculas. As formas dos peptídeos em solução tendem a flutuar, e dependendo das condições, os processos complexos através dos quais os peptídeos aderem às superfícies permitem que eles controlem o crescimento do cristal como um conjunto de 'interruptores, aceleradores e freios ', ”Friddle diz. “Eles podem desacelerar ou acelerar o crescimento, ou até mesmo desligue-o bruscamente com pequenas mudanças nas condições da solução. ”
A equipe planeja usar sua nova abordagem para investigar a física fundamental das superfícies de cristal em soluções e aprofundar sua compreensão de como as biomoléculas e os cristais interagem. “Acreditamos que esses resultados estabelecerão as bases para um melhor controle sobre os cristais tecnológicos, abordagens biomiméticas para síntese de materiais, e potenciais terapias para patologias do tecido duro, ”DeYoreo acrescenta.